

Explorez les implications cliniques d’un taux élevé de FR dans la PR
PR = polyarthrite rhumatoïde;
FR = facteur rhumatoïde.
Le FR est un auto-anticorps qui cible la région Fc des anticorps IgG présents chez de nombreux patients atteints de PR. Il s'agit d'un biomarqueur couramment utilisé pour la maladie.1 Un taux élevé de FR dans la PR est associé à une plus grande activité de la maladie et à un risque accru de progression radiographique.2,3 Des études récentes ont montré que l’élimination du médicament et la réponse clinique à certains anti-TNF peuvent être affectées par un taux élevé de FR.4,5 Par conséquent, les taux sériques de FR doivent être pris en compte lors de la prise de décisions cliniques chez les patients atteints de PR.2
Le FR est un facteur de risque et un biomarqueur couramment utilisé dans la PR
La PR est une maladie inflammatoire chronique des articulations qui entraîne des lésions du cartilage et des os, et qui est associée à des taux élevés d'invalidité, à une morbidité et à une mortalité accrues, en plus de nuire considérablement à la qualité de vie des patients.1,6,7
Le FR est un auto-anticorps physiologique présent dans le sérum et le liquide synovial de près de 80 % des patients atteints de PR et constitue un biomarqueur couramment utilisé dans cette maladie.1,8 Le FR peut être utilisé comme outil diagnostique, prédicteur de la réponse aux médicaments et indicateur pronostique.1,9
- Dans une étude, des sujets de la population générale affichant un taux élevé de FR* (> 100 UI/mL) par rapport à un taux faible (< 25 UI/mL) présentaient10:
-
Un risque de PR
à long terme jusqu'à
26 fois
plus élevéUn risque absolu
pouvant atteindre
32 %
d’être atteints
de PR après 10 ans
*Les valeurs de positivité du FR et les définitions d'un FR élevé varient en fonction du laboratoire ou de l'étude.
Le FR joue un rôle clé dans la biopathologie de la PR
Le FR est lié à l'inflammation dépendante des cytokines qui sous-tend la PR,8 par son interaction avec la région Fc des anticorps IgG et la formation de complexes immuns.5 Le FR est présent dans plusieurs isotypes d'immunoglobulines (IgM, IgG et IgA), mais le plus répandu dans la PR est l'IgM-FR. Chaque molécule d'IgM-FR peut se lier à jusqu'à 10 régions IgG1-Fc, ce qui facilite l'élimination des complexes immuns.1,5
L'ACPA est un autre auto-anticorps qui se manifeste chez la plupart des patients atteints de PR.1 L'ACPA contribue à la fixation du FR et à la formation du complexe immun, ce qui entraîne l'activation du complément en aval.1 Ces complexes immuns contribuent à la PR lorsqu'ils se forment dans les foyers d'inflammation synoviale.1
La fixation du FR entraîne la formation d'un complexe immun1
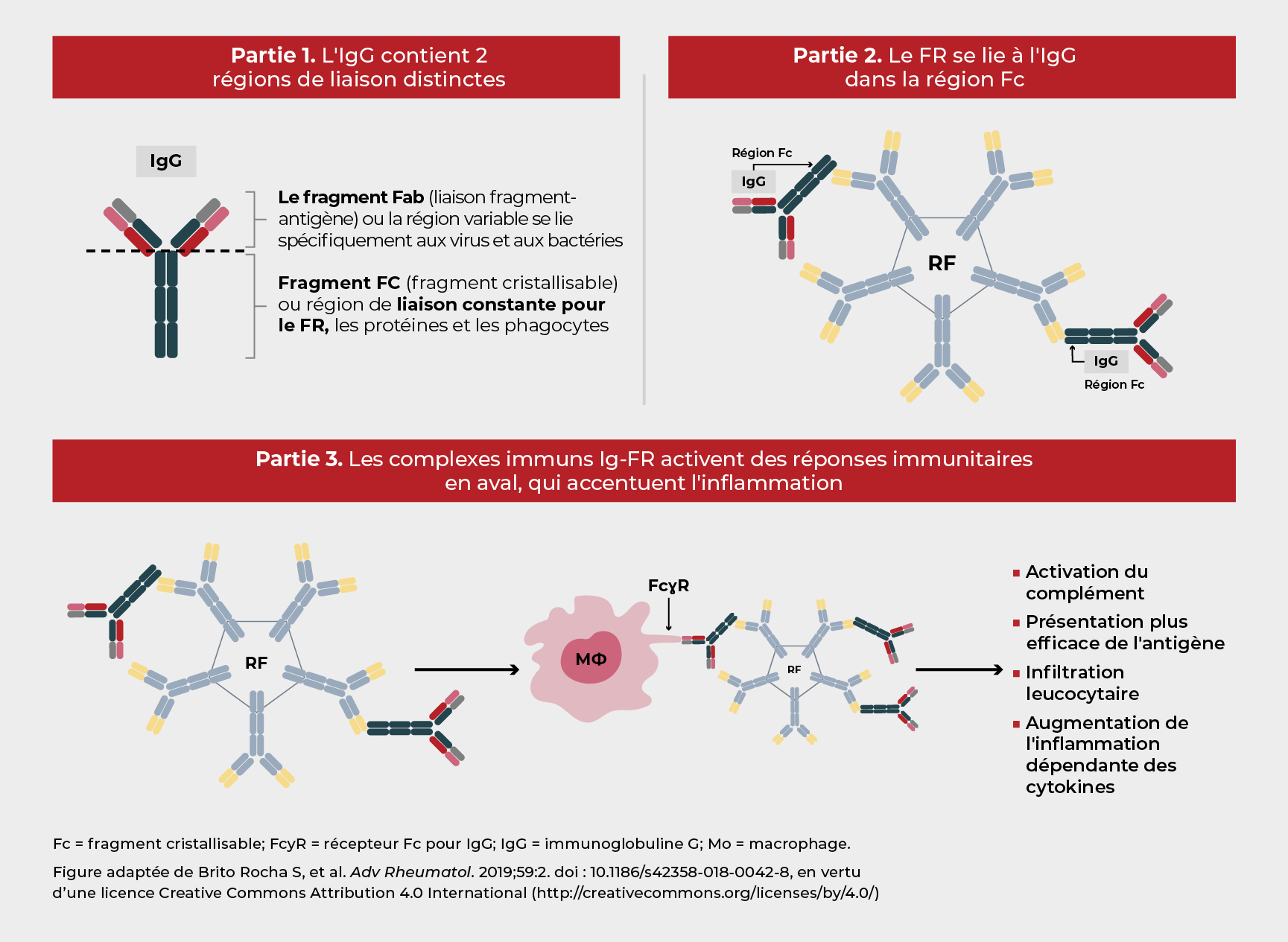
La présence du FR et d’ACPA est liée au déclenchement d'une inflammation dépendante des cytokines dans la PR11,12
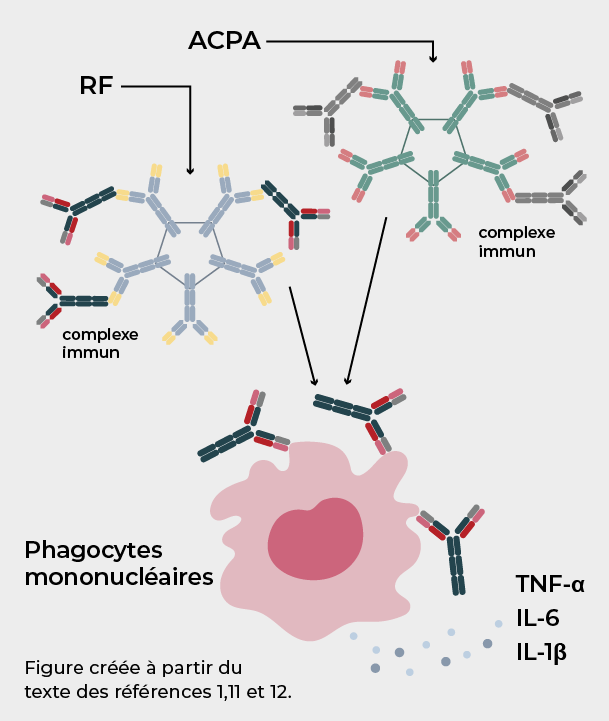
Le rôle du FR dans la biopathologie de la PR n'a pas encore été entièrement élucidé; cependant, il a été proposé que le FR potentialise les effets pathologiques de l'ACPA. Après la reconnaissance de l'antigène par ces auto-anticorps, le complexe immun formé peut activer les phagocytes mononucléaires dans la circulation et les articulations, favorisant la sécrétion de médiateurs inflammatoires, tels que le TNF-α, l'IL-6 et l'IL-1β. Ces cytokines ont été associées au déclenchement de l'inflammation chronique dans la PR.11,12
Une étude a montré que des taux accrus de cytokines pro-inflammatoires associées à la PR étaient observés chez les patients présentant des taux élevés de FR et d'ACPA.12
La réponse inflammatoire généralisée survenant en présence du FR et d’ACPA est caractérisée par des taux sériques plus élevés de cytokines associées au FR12
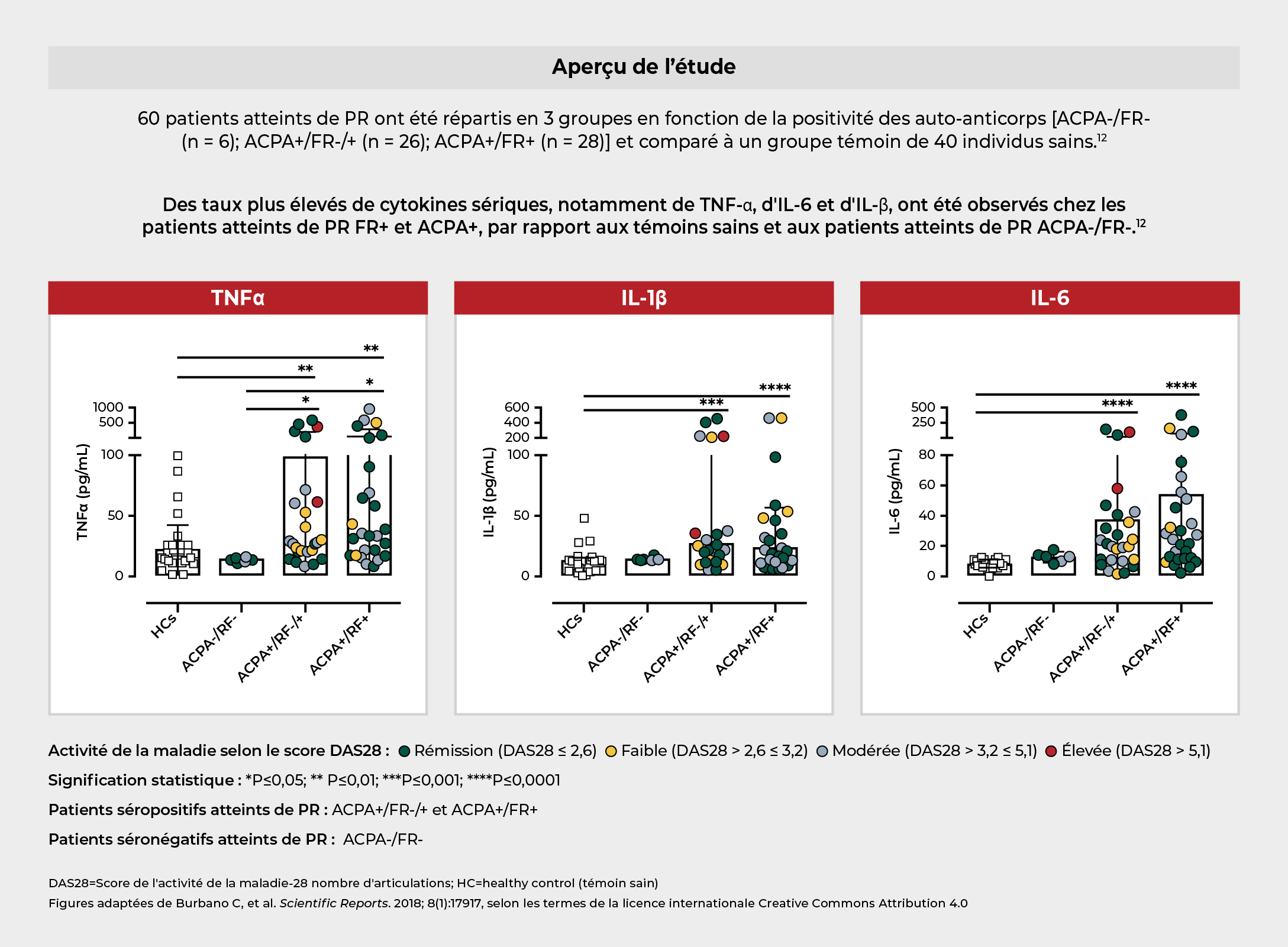
Un taux élevé de FR peut aggraver la maladie chez les patients atteints de PR
Un FR est un facteur prédictif de mauvais pronostic et est associée à une évolution plus agressive et destructrice de la maladie.5,8
- Chez les patients atteints de PR, un taux élevé de FR est associé à
-



Besoins cliniques non satisfaits chez les patients atteints de PR dont le taux de FR est élevé
Comptant deux décennies d’expérience, les anti-TNF sont des agents biologiques de première intention reconnus dans le traitement de la PR. Cependant, de nombreux patients atteints de PR présentent des réponses cliniques sous-optimales après un traitement initial par des anti-TNF.16,17

Une étude de cohorte longitudinale portant sur plus de 2 000 patients atteints de PR a montré que jusqu'à 40 % des patients traités par des anti-TNF sur une période de deux ans peuvent répondre à ce traitement de manière inadéquate, soit en raison d'une absence de réponse primaire, d'une perte de réponse ou d'une intolérance.16,17
- Il a été établi qu’un taux élevé de FR contribue à altérer les résultats cliniques des patients atteints de PR ayant reçu un traitement par certains anti-TNF4
-

Taux de rémission
réduits
Probabilité plus faible
d'amélioration de
la maladie
Réponse plus faible
à certains traitements
anti-TNF
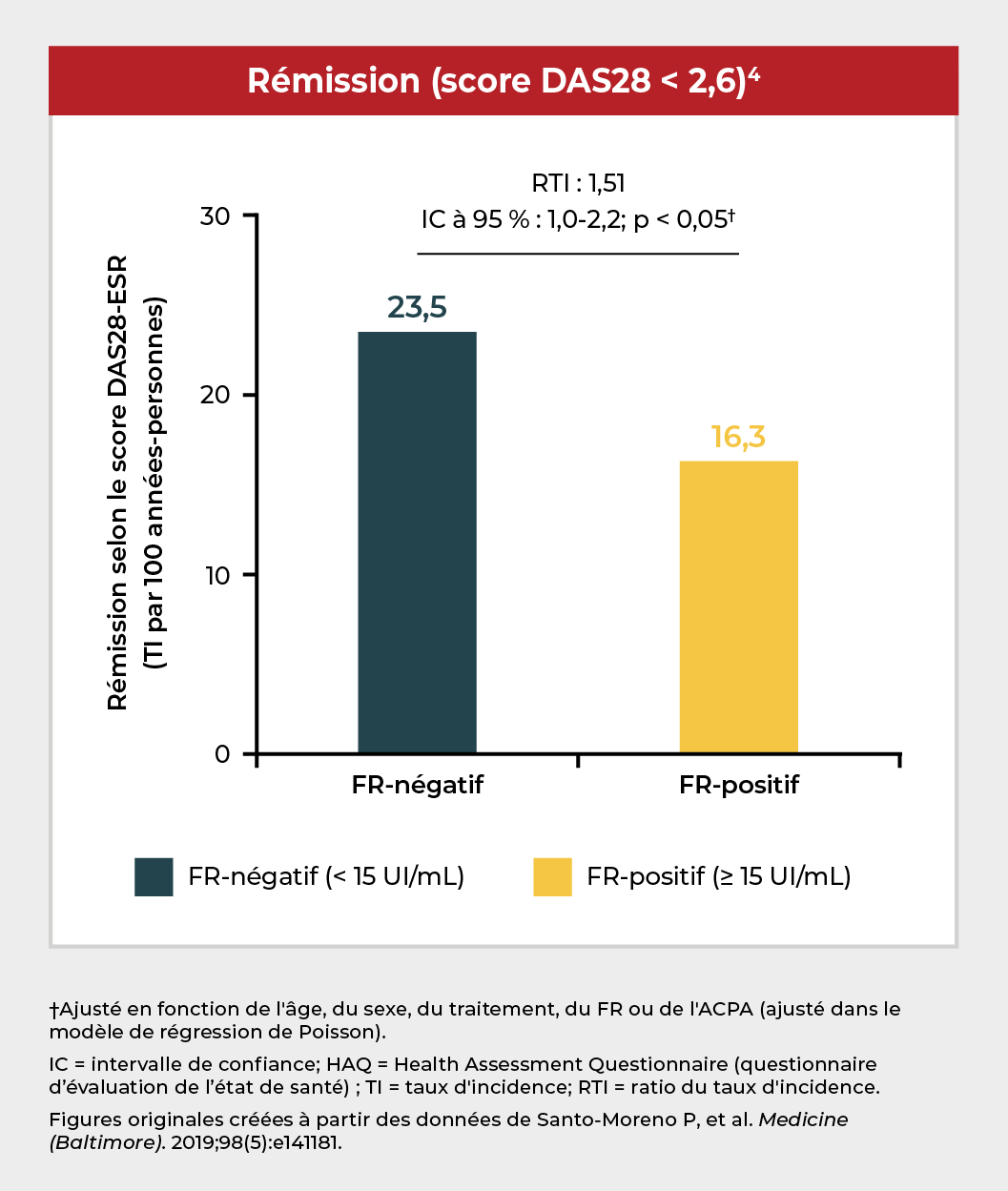
La présence de FR est associée à une invalidité sévère et à une moindre probabilité de rémission de la maladie
Dans une étude de cohorte menée chez environ 400 patients traités par un anti-TNF, la présence de FR (≥ 15 UI/mL) a été associée à une invalidité sévère et à une moindre probabilité de rémission de la maladie par rapport aux patients chez qui le FR était absent.4
* Y compris l'étanercept, l'infliximab, l'adalimumab ou le golimumab.
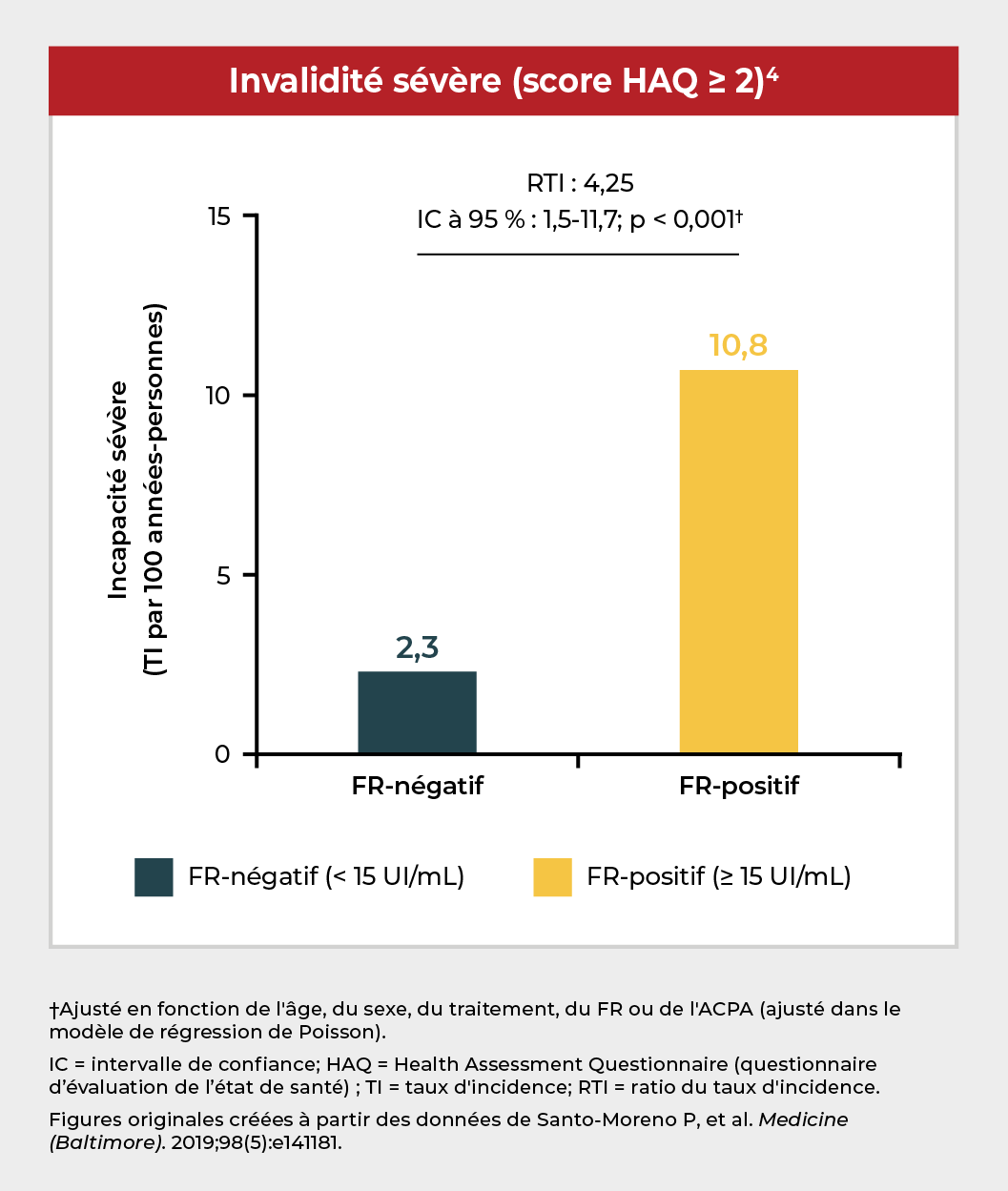
D'autres études ont également démontré que les faibles réponses cliniques à certains anti-TNF peuvent être liées à des taux élevés de FR :
Dans une étude de cohorte britannique menée chez des patients atteints de PR (N = 642), la positivité sérique initiale des IgM-FR (≥ 40 U/μL) était associée à une réponse amoindrie au traitement anti-TNF.18
Les données d'un registre japonais (n = 1 151) ont montré que la présence de FR était prédictive de l'arrêt du traitement anti-TNF pour cause d'inefficacité et qu'elle était inversement associée à la rémission selon le score DAS28-ESR.19


L'importance de prendre en compte les taux de FR lors de la prise de décisions cliniques
Plusieurs études ont montré que des résultats cliniques médiocres sont associés à des taux élevés de FR chez les patients atteints de PR et traités par certains anti-TNF.4,18,19 Ces résultats laissent croire que les taux sériques de FR devraient être mesurés et utilisés pour faciliter l’établissement de stratégies de traitement et la prise de décision clinique.2
En outre, certaines données donnent à penser que la réponse au traitement pourrait être liée à des différences entre les anti-TNF.20
https://www.rheumuseum.ca/
- de Brito Rocha S, Baldo DC, Andrade LEC. Clinical and pathophysiologic relevance of autoantibodies in rheumatoid arthritis. Adv Rheumatol. 2019;59:2. doi: 10.1186/s42358-018-0042-8
- Aletaha D, Alasti F, Smolen JS. Rheumatoid factor, not antibodies against citrullinated proteins, is associated with baseline disease activity in rheumatoid arthritis clinical trials. Arthritis Res Ther. 2015;17(1):229. doi: 10.1186/s13075-015-0736-9
- Aletaha D, Alasti F, Smolen JS. Rheumatoid factor determines structural progression of rheumatoid arthritis dependent and independent of disease activity. Ann Rheum Dis. 2013;72(6):875-880. doi: 10.1136/annrheumdis-2012-201517
- Santos-Moreno P, Sánchez G, Castro C. Rheumatoid factor as predictor of response to treatment with anti-TNF alpha drugs in patients with rheumatoid arthritis: Results of a cohort study. Med (Baltimore). 2019;98:5. doi: 10.1097/MD.0000000000014181
- Tanaka Y, Takeuchi T, Haaland D, et al. Efficacy of certolizumab pegol across baseline rheumatoid factor subgroups in patients with rheumatoid arthritis: Post-hoc analysis of clinical trials. Int J Rheum Dis. 2023;26(7):1248-1259. doi: 10.1111/1756-185X.14699
- Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet. 2016;388(10055):2023-2038. doi: 10.1016/S0140-6736(16)30173-8
- Scott DL, Wolfe F, Huizinga TW. Rheumatoid arthritis. Lancet. 2010;376(9746):1094-1108. doi: 10.1016/S0140-6736(10)60826-4
- Mathsson L, Lampa J, Mullazehi M, et al. Immune complexes from rheumatoid arthritis synovial fluid induce FcgammaRIIa dependent and rheumatoid factor correlated production of tumour necrosis factor-alpha by peripheral blood mononuclear cells. Arth Res Ther. 2006;8(3):1-10. doi: 10.1186/ar1926
- Bobbio-Pallavicini F, Caporali R, Alpini C, Avalle S, et al. High IgA rheumatoid factor levels are associated with poor clinical response to tumour necrosis factor alpha inhibitors in rheumatoid arthritis. Ann Rheum Dis. 2007;66:302-307. doi: 10.1136/ard.2006.060608
- Nielsen SF, Bojesen SE, Schnohr P, et al. Elevated rheumatoid factor and long term risk of rheumatoid arthritis: a prospective cohort study. BMJ. 2012; Sep 6;345:e5244. doi: 10.1136/bmj.e5244
- Mueller AL, Payandeh Z, Mohammadkhani N, et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: new treatment strategies. Cells. 2021; Nov 4;10(11):3017. doi: 10.3390/cells10113017
- Burbano C, Rojas M, Muñoz-Vahos C, et al. Extracellular vesicles are associated with the systemic inflammation of patients with seropositive rheumatoid arthritis. Sci Rep. 2018;8(1):17917. doi: 10.1038/s41598-018-36335-x
- Cojocaru M, Cojocaru IM, Silosi I, et al. Extra-articular manifestations in rheumatoid arthritis. Maedica (Bucur). 2010;5(4):286-291
- Sobhy N, Ghoniem SA, Eissa BM, et al. Disease characteristics in high versus low titers of rheumatoid factor or anti-citrullinated peptide antibody in rheumatoid arthritis patients. Egypt Rheumatol. 2022;44(4):325-328. doi: 10.1016/j.ejr.2022.04.004
- ElSherbiny D. Frequency and predictors of extra-articular manifestations in patients with rheumatoid arthritis. EJHM. 2019;76(5):4062-4067. doi: 10.21608/ejhm.2019.42300
- Taylor PC, Matucci Cerinic M, Alten R, et al. Managing inadequate response to initial anti-TNF therapy in rheumatoid arthritis: optimising treatment outcomes. Ther Adv Musculoskelet Dis. 2022;14:1-14. doi: 10.1177/1759720X221114101
- Aaltonen KJ, Ylikylä S, Tuulikki Joensuu J, et al. Efficacy and effectiveness of tumour necrosis factor inhibitors in the treatment of rheumatoid arthritis in randomized controlled trials and routine clinical practice. Rheumatology. 2017;56:725-735. doi: 10.1093/rheumatology/kew467
- Potter C, Hyrich KL, Tracey A, et al. Association of rheumatoid factor and anti-cyclic citrullinated peptide positivity, but not carriage of shared epitope or PTPN22 susceptibility variants, with anti-tumour necrosis factor response in rheumatoid arthritis. Ann Rheum Dis. 2009;68(1):69-74. doi: 10.1136/ard.2007.084715
- Ogawa Y, Takahashi N, Kaneko A, et al. Association between seropositivity and discontinuation of tumor necrosis factor inhibitors due to ineffectiveness in rheumatoid arthritis. Clin Rheumatol. 2019;38:2757-2763. doi: 10.1007/s10067-019-04626-x
- Nakayama Y, Watanabe R, Murakami K, et al. Differential efficacy of TNF inhibitors with or without the immunoglobulin fragment crystallizable (Fc) portion in rheumatoid arthritis: the ANSWER cohort study. Rheumatol Int. 2022;42(7):1227-1234. doi: 10.1007/s00296-021-05086-w