

ENTREZ DANS LA PREMIÈRE EXPOSITION
Explorez la pathobiologie du PsA
PsA = rhumatisme psoriasique.
La pathogénèse inflammatoire chronique du PsA est complexe et multifactorielle…
…Impliquant différentes cellules adaptive and innate immune cells and pro-inflammatory de l’immunité adaptative et innée et des cytokines pro-inflammatoires.1
Les processus pathologiques du PsA
Les processus pathologiques du PsA ne sont pas encore totalement compris. Des études récentes ont cependant révélé l’existence d’une interaction complexe entre les voies de cytokines et les cellules qui sont responsables de l’activation et du maintien de l’inflammation chronique associée à ses diverses manifestations cliniques.1-4 Les signes pathologiques du PsA diffèrent souvent en fonction de la manifestation clinique.1,2
Téléchargez une clé pour vous guider dans la lecture de chaque pièce
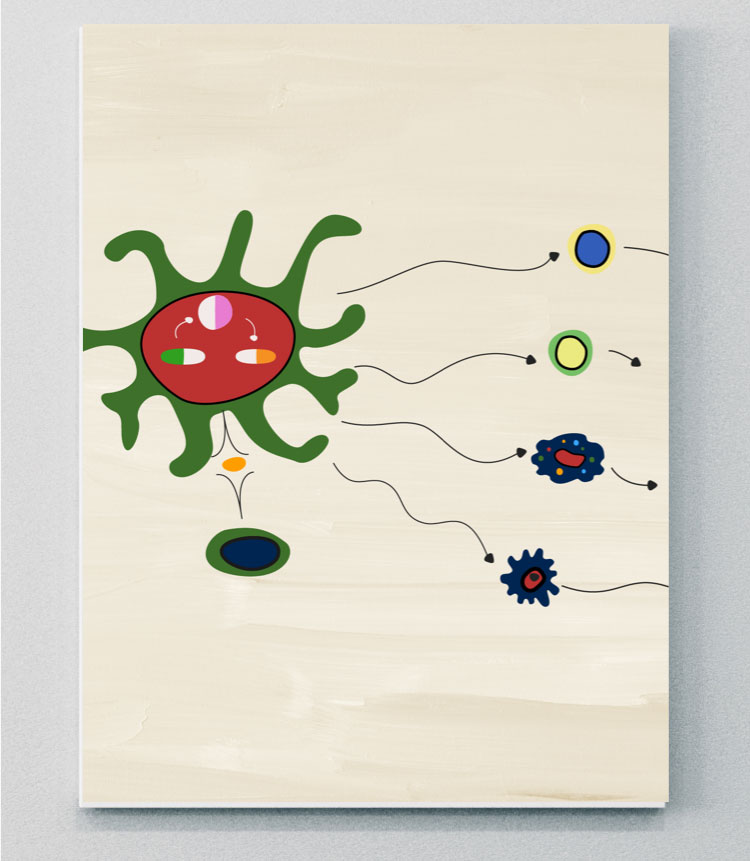
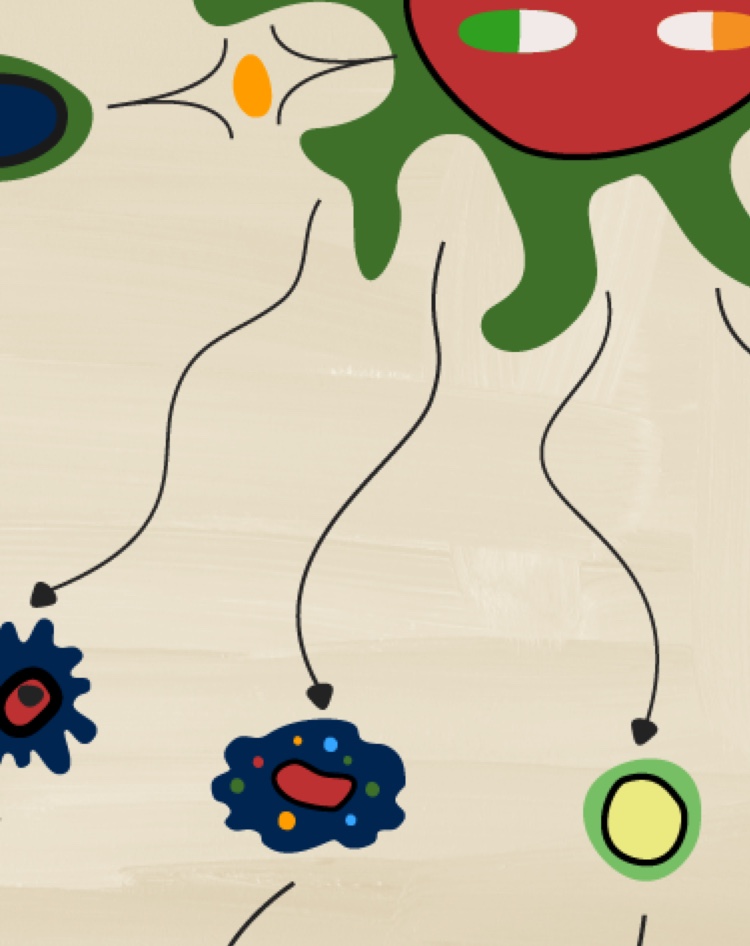
Le rôle des cytokines dans l'activation de l'inflammation
Les résultats d’études récentes montrent que différentes cytokines, notamment les IL-17A, IL-17F, TNF, IL-12 et IL-23, ainsi que l’implication directe ou indirecte de la voie JAK/STAT et de la PDE-4, ont des rôles distincts dans l’activation de l’inflammation de différents tissus dans les SpA. Malgré la complexité des contributions relatives de chacune d’entre elles, des distinctions importantes émergent en ce qui concerne l’implication des cytokines dans certaines manifestations cliniques et phénotypes cliniques des SpA.4,5,6,7-9
Téléchargez une clé pour vous guider dans la lecture de chaque pièce
JAK = Janus kinase.


Famille de l'IL-17
La famille des cytokines de l'IL-17 6 membres appelés IL-17A, IL-17B, IL-17C, IL-17D, IL-17E et IL-17F.10,14
L’IL-17A et l’IL-17F sont proches en termes de structure avec une homologie d’environ 50 % et ont une fonction pro-inflammatoire similaire, en activant leur voie de signalisation par le biais du même complexe récepteur.13 Des études ont montré que l’IL-17A et l’IL-17F existent à la fois sous la forme d’homodimères et d’hétérodimères, c’est-à-dire que 3 cytokines existent (IL-17A/A, IL-17A/F et IL-17F/F), et qu’elles ont toutes démontré leur caractère pro-inflammatoire dans le PsA.13,15
La famille des récepteurs de l’IL-17 compte cinq membres. Il semble que deux récepteurs de l’IL-17 (IL-17RC et IL-17RA) agissent de concert comme médiateurs des signaux de l’IL-17A/A, l’IL-17F/F et de l’IL-17A/F.12,14
Des études ont montré que l’IL-17A et l’IL-17F coopèrent avec d’autres médiateurs de l’inflammation, comme les TNF, pour amplifier la réponse inflammatoire.13 La contribution de l’IL-17A et de l’IL-17F à la formation anormale de tissus osseux a été démontrée dans un modèle de différenciation ostéogénique, ce qui indique l’importance de l’IL-17A et de l’IL-17F dans l’ostéogenèse.13
Dans le PsA, les lésions cutanées et la synoviale enflammée ont des profils similaires en ce qui concerne l’expression et l’augmentation de la production d’IL-17A et d’IL-17F, et bien que l’IL-17A soit plus puissante que l’IL-17F, le taux de protéines de l’IL-17F est environ 30 fois plus élevé que celui de l’IL-17A.16
Les résultats d’études semblent indiquer que l’IL-17 est régulée par des voies IL-23 dépendantes et IL-23 indépendantes
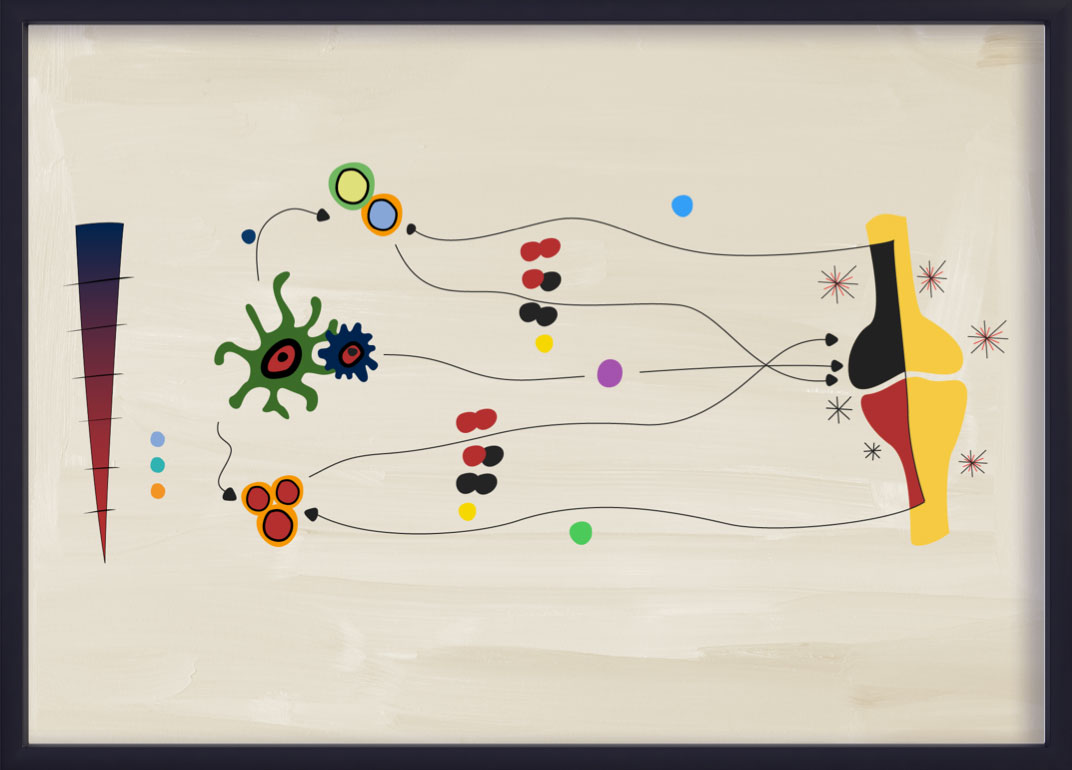
Le processus de l’axe IL-23–IL-17
L’IL-23 amplifie la prolifération et pérennise la présence des sous-ensembles de Th17, y compris la production d’IL-17A et d’IL-17F par les cellules Th17. Ce processus, communément appelé « axe IL-23–IL-17 », a été impliqué dans plusieurs maladies inflammatoires, notamment le PsA.14,15,20,21
Des résultats d’études récentes semblent indiquer que l’axe IL-23–IL-17 n’est pas une « cascade » linéaire dans le PsA.22 Les propriétés biologiques et pathobiologiques de l’IL-23 et de l’ IL-17 se chevauchent partiellement mais avec des différences.22 Bien que l’on pense encore que la voie IL-23–IL-17 de l'immunité adaptative joue un rôle clé dans l’activation de l’inflammation dans le PsA, les cellules du système immunitaire inné peuvent également produire des IL-17A et IL-17F indépendamment de l’IL-23.20,22 La voie de signalisation des cellules adaptatives dans le PsA est en grande partie activée par l’IL-23.21,23


IL-23
L’IL-23 régulateur important en amont de l’IL-17 dans le PsA14,22
L’IL-23, un membre de la superfamille des IL-12, est un hétérodimère constitué des sous-unités p40 et p19.14,21 Il s’agit d’une cytokine importante impliquée dans la pathogénèse de plusieurs maladies inflammatoires à médiation immunitaire, notamment le psoriasis, le PsA, l’axSpA et les MICI.21 Son interaction avec différentes cellules et voies de cytokines en aval n’est néanmoins pas toujours identique en ce qui concerne ces maladies.21
Certains résultats d’études montrent que l’IL-23 peut migrer au travers des sites barrières comme la barrière cutanée ou intestinale, dans lesquelles les cellules dendritiques ont été activées, et atteindre les sites de pathogenèse du PsA. Cela doit cependant faire l’objet d’une étude plus approfondie.21
Un rôle pro-inflammatoire clé de l’IL-23 est son activation des cellules Th17 pour la production d’IL-17, d’IL-22 et de TNF, ce qui provoque par la suite l’inflammation en aval, la formation de tissus osseux et des érosions osseuses.6,14,21 De récentes études ont cependant montré que l’IL-23 pourrait également avoir un rôle de signalisation dans le PsA.21,23 La dépendance vis-à-vis de l’IL-23 pour l’activation de la signalisation pathogène semble varier en fonction des différentes maladies inflammatoires, et la signalisation directe de l’IL-23 joue peut-être un rôle plus important dans le PsA que dans l’axSpA.21,23 Cela peut avoir un rapport avec les différents sites d’expression des cytokines. Par exemple, il a été démontré que l’expression des cytokines liée à l’axe IL-23–IL-17 axis est continuelle dans l’épiderme malade, mais qu’elle est variable au niveau des articulations.6,21,23
L’IL-23 agit sur de nombreuses cellules cibles par le biais d’un mécanisme IL-17-dépendant ou IL-17-indépendant, qui active dans les deux cas le recrutement de cellules inflammatoires dans le tissu inflammatoire.23
- Voie IL-17 dépendante : L’IL-23 active les cellules Th17 via l’IL-23R et induit la sécrétion de molécules telles que les IL-17 ou IL-22. En se liant à leurs récepteurs IL-17R ou IL-22R cognats, elles activent à un moment donné les « cellules effectrices » kératinocytes, cellules B, précurseurs d’ostéoclastes, macrophages et synoviocytes similaires aux fibroblastes.23
- Voie IL-17 indépendante : Le même sous-ensemble de cellules cibles peut être directement stimulé par l’IL-23 de manière IL-17-indépendante via l’IL-23R.23
MICI = Maladie inflammatoire chronique de l’intestin.


IL-12
Rôle de l’IL-12 dans le PsA
L’IL-12 est une cytokine pro-inflammatoire composée de deux sous-unités (p35 et p40), créant un hétérodimère actif p70.26 Produite par des cellules de l’immunité innée, elle induit la différenciation des cellules T naïves en cellules Th1 sécrétrices d’IFN-gamma et de stimuler l’activité des cellules T.26,27
L’activité de l’IL-12 et celle de l’IL-23 sont étroitement liées. Ces deux cytokines inflammatoires ont en commun la sous-unité p40 et une chaîne de récepteur (IL-12R1), qui contrôle les voies de signalisation distinctes de l’IL-12 et de l’IL-23.26
Dans le PsA, la suractivation de l’IL-12 et de l’IL-23 augmente le nombre de cellules Th1 et Th17 qui circulent. Cela active la signalisation des cytokines et des protéines, ce qui peut provoquer le développement de plaques de psoriasis.28,29 La susceptibilité au PsA a été lié à des polymorphismes mononucléotidiques du gène Il-12b qui code la sous-unité du ligand de l’IL-23R.26


TNF
La signalisation des TNF joue un rôle dans les processus pathogènes du PsA
La superfamille des TNF (TNFSF) comporte 19 cytokines pléiotropiques dont la structure est similaire.31,32 Les protéines de la TNFSF sont des facteurs clé de l’inflammation et sont impliqués dans la médiation de l’apoptose, l’angiogenèse, la prolifération cellulaire, ainsi que d’autres fonctions biologiques d’importance critique.31
Le TNF-α existe sous formes transmembranaire et soluble, et est essentiellement produit par des cellules T, des cellules NK et des macrophages.33 La signalisation cellulaire du TNF-α se fait par l’intermédiaire de 2 récepteurs—TNFR1 et TNFR2—dont les mécanismes de signalisation cellulaire, l’affinité de liaison aux ligands et les schémas d’expression sont différents.34,35 Le TNFR1 est le récepteur dominant qui est impliqué dans les réponses inflammatoires et immunitaires innées.36
La surexpression de TNF produit un état pro-inflammatoire pathogène qui semble être médié par les cellules Th1 et Th17.32 Des taux élevés de TNF peuvent être détectés dans la synoviale et dans d’autres sites propices aux manifestations cutanées et aux atteintes des enthèses, des articulations et du rachis.30,37 Les cellules dendritiques activées sécrètent des TNF-α et d’autres cytokines pro-inflammatoires (IL-6, IL-12, IL-23, etc.), ce qui stimule la signalisation des cellules T et la différenciation des cellules Th.32 Les cellules Th1 et Th17 augmentent la production de cytokines pro-inflammatoires de la synoviale, ce qui provoque par la suite la production d’ostéoclastes, des érosions osseuses/du cartilage et la formation anormale de tissus osseux.38
Dans le PsA, le TNF peut a gir en synergie avec les voies de l’IL-17 et de l’IL-23 :
- L’IL-23 active la différenciation des cellules Th17, ce qui provoque la production de cytokines comme l’IL-17 et une augmentation de la production de TNF35
- Les IL-17 se combinent avec les TNF et créent une expression des cytokines pro-inflammatoires plus importante que si chacune de ces cytokines agissait seule39


JAK-STAT
Les voies JAK-STAT pourraient jouer un rôle important dans la pathogénèse du PsA
Les molécules JAK sont un groupe de tyrosine-kinases intracellulaires comprenant 4 isoformes : JAK1, JAK2, JAK3 et tyrosine-kinase (TYK) 2.41 Ces groupes sont couplés avec des molécules transductrices de signaux et activatrices de transcription (STAT).9 De nombreuses cellules immunitaires et molécules effectrices utilisent différentes combinaisons de molécules JAK et STAT pour convertir les signaux de la surface cellulaire au noyau, où elles activent la transcription et induisent l’activation des gènes. Cette activation des gènes en aval a un rôle de régulation des différents processus biologiques, y compris l’activation des voies pathologiques dans le PsA.9,40,42 De nombreuses cytokines associées à la SpA sont médiées directement ou indirectement par l’intermédiaire de voies JAK-STAT.40
JAK = Janus kinase ; TYK = Tyrosine-kinase.

PDE4
Un médiateur cellulaire de la réponse inflammatoire responsable du PsA
La PDE4 est un membre de la famille des enzymes phosphodiestérases, qui catalysent la dégradation des seconds messagers intracellulaires, notamment les AMPc et GMPc, et sont impliqués dans de nombreux mécanismes inflammatoires différents.4
Dans le PsA, la régulation de la AMPc est altérée, la conséquence probable des augmentations de PDE4, ce qui catalyse la transformation de l’AMPc en AMP par hydrolysation.4,43 Les augmentations de taux d’AMP peuvent alors provoquer un déséquilibre des cytokines inflammatoires (augmentations de l’expression de cytokines inflammatoires par les TNF, IL-17, IFN, IL-23, et réductions des cytokines régulatrices, comme l’IL-10), ce qui active les voies inflammatoires responsables de la formation anormale de tissus osseux et des érosions osseuses.4,44
PDE = Phosphodiestérase.
Veuillez vous asseoir dans le théâtre de la science animée
Découvrez les mécanismes pathogéniques du PsA, notamment le rôle des IL-17A et IL-17F

Découvrez les rôles distincts de différentes cytokines dans l’activation de l’inflammation dans le PsA


SALLE SUIVANTE DE L’EXPOSITION SUR LE PSA
Dysrégulation immunitaire
Étudiez comment la dysrégulation des cytokines conduit à l’inflammation chez les patients atteints de PsA.
Pour de plus amples informations sur l’axSpA et le PsA, veuillez vous inscrire sur le site UCBCares® Rhumatologie
- Veale DJ, Fearon U. The pathogenesis of psoriatic arthritis [La pathogénèse du rhumatisme psoriasique]. Lancet. 2018;391(10136):2273-2284. doi:10.1016/S0140-6736(18)30830-4
- Bravo A, Kavanaugh A. Bedside to bench: defining the immunopathogenesis of psoriatic arthritis [Du chevet du lit à la paillasse : définir l'immunopathogénèse du rhumatisme psoriasique]. Nat Rev Rheumatol. 2019;15(11):645-656. doi:10.1038/s41584-019-0285-8
- Crispino N, Ciccia F. JAK/STAT pathway and nociceptive cytokine signaling in rheumatoid arthritis and psoriatic arthritis [La signalisation de la voie JAK/STAT et des cytokines nociceptives dans la polyarthrite rhumatoïde et le rhumatisme psoriasique]. Clin Exp Rheumatol. 2021;39(3):668-675
- Picchianti-Diamanti A, Spinelli FR, Rosado MM, et al. Inhibition of phosphodiesterase-4 in psoriatic arthritis and inflammatory bowel diseases [Inhibition de la phosphodiestérase-4 dans le rhumatisme psoriasique et les maladies inflammatoires chroniques de l'intestin]. Int J Mol Sci. 2021;22(5):2638. Published 2021 Mar 5. doi:10.3390/ijms22052638
- Rezaiemanesh A, Abdolmaleki M, Abdolmohammadi K, et al. Immune cells involved in the pathogenesis of ankylosing spondylitis [Cellules de l’immunité impliquées dans la pathogénèse de la spondylarthrite ankylosante]. Biomed Pharmacother. 2018;100:198-204. doi:10.1016/j.biopha.2018.01.108
- McGonagle DG, McInnes IB, Kirkham BW, et al. The role of IL-17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies [Le rôle de l’IL-17A dans la spondylarthrite axiale et le rhumatisme psoriasique : avancées et controverses récentes] [correction publiée dans le Ann Rheum Dis. 2020;79(1):e12]. Ann Rheum Dis. 2019;78(9):1167-1178. doi:10.1136/annrheumdis-2019-215356
- Siebert S, Millar NL, McInnes IB. Why did IL-23p19 inhibition fail in AS: a tale of tissues, trials or translation? [Quelles sont les raisons de l’échec de l’inhibition des Il-23p19 dans la SA : une histoire de tissus, d’essais ou de traduction ?]. Ann Rheum Dis. 2019;78(8):1015-1018. doi:10.1136/annrheumdis-2018-213654
- Rosine N, Miceli-Richard C. Innate cells: the alternative source of IL-17 in axial and peripheral spondyloarthritis? [Cellules innées : l’autre source d’IL-17 dans les spondylarthrites axiales et périphériques ?]. Front Immunol. 2021;11:553742. Published 2021. doi:10.3389/fimmu.2020.553742
- Hammitzsch A, Lorenz G, Moog P. Impact of janus kinase inhibition on the treatment of axial spondyloarthropathies [Impact de l’inhibition de la janus kinase dans le traitement de la spondylarthrite axiale]. Front Immunol. 2020;11:591176. Published 2020. doi:10.3389/fimmu.2020.591176
- Yang XO, Chang SH, Park H, et al. Regulation of inflammatory responses by IL-17F [Régulation des réponses inflammatoires par l’IL-17F]. J Exp Med. 2008;205(5):1063-1075. doi:10.1084/jem.20071978
- Shah M, Maroof A, Gikas P, et al. Dual neutralisation of IL-17F and IL-17A with bimekizumab blocks inflammation-driven osteogenic differentiation of human periosteal cells [La double neutralisation de l’IL-17F et de l’IL-17A produite par le bimekizumab bloque la différenciation ostéogénique provoquée par l’inflammation de cellules humaines issues du périoste]. RMD Open. 2020;6(2):e001306. doi:10.1136/rmdopen-2020-001306
- Goepfert A, Lehmann S, Blank J, et al. Structural Analysis Reveals that the Cytokine IL-17F Forms a Homodimeric Complex with Receptor IL-17RC to Drive IL-17RA-Independent Signaling [Une analyse structurelle montre que la cytokine IL-17F forme un complexe homodimèrique avec le récepteur IL-17RC pour activer une signalisation indépendante de l’IL-17RA]. Immunity. 2020;52(3):499-512.e5. doi:10.1016/j.immuni.2020.02.004
- Glatt S, Baeten D, Baker T, et al. Dual IL-17A and IL-17F neutralisation by bimekizumab in psoriatic arthritis: evidence from preclinical experiments and a randomised placebo-controlled clinical trial that IL-17F contributes to human chronic tissue inflammation [La double neutralisation de l’IL-17A et de l’IL-17F produite par le bimekizumab dans le rhumatisme psoriasique : résultats d’expériences précliniques et d’un essai clinique randomisé, contrôlé contre placebo, prouvant que l’IL-17F contribue à l’inflammation chronique de tissus humains]. Ann Rheum Dis. 2018;77(4):523-532. doi:10.1136/annrheumdis-2017-212127
- Tsukazaki H, Kaito T. The role of the IL-23/IL-17 pathway in the pathogenesis of spondyloarthritis [Le rôle de la voie IL-23/IL-17 dans la pathogénèse des spondyloarthrites]. Int J Mol Sci. 2020;21(17):6401. Published 2020. doi:10.3390/ijms21176401
- Bridgewood C, Sharif K, Sherlock J, et al. Interleukin-23 pathway at the enthesis: The emerging story of enthesitis in spondyloarthropathy [La voie interleukine 23 dans l’enthèse : émergence de la question de l’enthésite dans les spondylarthrites]. Immunol Rev. 2020;294(1):27-47. doi:10.1111/imr.12840
- Ritchlin CT, Kavanaugh A, Merola JF, et al. Bimekizumab in patients with active psoriatic arthritis: results from a 48-week, randomised, double-blind, placebo-controlled, dose-ranging phase 2b trial [Bimekizumab chez des patients atteints de rhumatisme psoriasique actif : résultats à 48 semaines d’un essai clinique de phase 2b d'adaptation posologique randomisé, en double aveugle, contrôlé contre placebo]. Lancet. 2020;395(10222):427-440. doi:10.1016/S0140-6736(19)33161-7
- Blanco P, Palucka AK, Pascual V, et al. Dendritic cells and cytokines in human inflammatory and autoimmune diseases [Les cellules dendritiques et les cytokines dans les maladies inflammatoires et auto-immunes chez l’homme]. Cytokine Growth Factor Rev. 2008;19(1):41-52. doi:10.1016/j.cytogfr.2007.10.004
- Cole S, Murray J, Simpson C, et al. Interleukin (IL)-12 and IL-18 synergize to promote MAIT cell IL-17A and IL-17F production independently of IL-23 signaling [Les interleukines IL-12 et IL-18 agissent en synergie pour favoriser la production d’IL-17A et d’IL-17F par les cellules MAIT, indépendamment de la signalisation de l'IL-23]. Front Immunol. 2020;11:585134. Published 2020. doi:10.3389/fimmu.2020.585134
- Russell T, Watad A, Bridgewood C, et al. IL-17A and TNF modulate normal human spinal entheseal bone and soft tissue mesenchymal stem cell osteogenesis, adipogenesis, and stromal function [Les IL-17A et TNF modulent l’ostéogénèse, l’adipogénèse et la fonction stromale normales humaines des enthèses du rachis et des cellules souches mésenchymateuses des tissus adipeux]. Cells. 2021;10(2):341. Published 2021. doi:10.3390/cells10020341
- McGonagle D, Watad A, Sharif K, et al. Why inhibition of IL-23 lacked efficacy in ankylosing spondylitis [Raisons pour lesquelles l’efficacité de l’inhibition de l’IL-23 n’était pas suffisante dans la spondylarthrite ankylosante]. Front Immunol. 2021;12:614255. Published 2021. doi:10.3389/fimmu.2021.614255
- Mease P, Van den Bosch F. IL-23 and axial disease: do they come together? [L’IL-23 et la maladie axiale : intersectent-elles ?] Rheumatology. 2021;60(Suppl 4):iv28-iv33. doi:10.1093/rheumatology/keab617
- Baeten D, Adamopoulos IE. IL-23 inhibition in ankylosing spondylitis: where did it go wrong? [L’inhibition de l’IL-23 dans la spondylarthrite ankylosante : où avons-nous fait fausse route ?]. Front Immunol. 2021;11:623874. Published 2021. doi:10.3389/fimmu.2020.623874
- Boutet MA, Nerviani A, Gallo Afflitto G, et al. Role of the IL-23/IL-17 axis in psoriasis and psoriatic arthritis: the clinical importance of its divergence in skin and joints [Le rôle de l’axe IL-23/IL-17 dans le psoriasis et le rhumatisme psoriasique : l’importance clinique de sa divergence en matière de peau et d’articulations]. Int J Mol Sci. 2018;19(2):530. Published 2018. doi:10.3390/ijms19020530
- Taams LS, Steel KJA, Srenathan U, et al. IL-17 in the immunopathogenesis of spondyloarthritis [L’IL-17 dans l'immunopathogénèse des spondyloarthrites]. Nat Rev Rheum. 2018;14(8):453–466. Published 2018. doi: 10.1038/s41584-018-0044-2
- Zhu W, He X, Cheng K, et al. Ankylosing spondylitis: etiology, pathogenesis, and treatments [Spondylarthrite ankylosante : étiologie, pathogénèse et traitements]. Bone Res. 2019;7:22. Published 2019. doi:10.1038/s41413-019-0057-8
- Schurich A, Raine C, Morris V, et al. The role of IL-12/23 in T cell-related chronic inflammation: implications of immunodeficiency and therapeutic blockade [Le rôle de l’IL-12/23 dans l’inflammation chronique liée aux cellules T : implications de l’immunodéficience et du blocage thérapeutique]. Rheumatology (Oxford). 2018;57(2):246-254. doi:10.1093/rheumatology/kex186
- Trinchieri G. Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adaptive immunity [L’interleukine 12 : une cytokine pro-inflammatoire dont les fonctions immunorégulatrices permettent de relier la résistance innée et l’immunité adaptative dirigée contre un antigène spécifique]. Annu Rev Immunol. 1995;13:251-276. doi:10.1146/annurev.iy.13.040195.001343
- Johnsson HJ, McInnes IB. Interleukin-12 and interleukin-23 inhibition in psoriatic arthritis [L’inhibition de l’interleukine-12 et de l’interleukine-23 dans le rhumatisme psoriasique]. Clin Exp Rheumatol. 2015;33(5 Suppl 93):S115-S118
- Chyuan IT, Lai JH. New insights into the IL-12 and IL-23: From a molecular basis to clinical application in immune-mediated inflammation and cancers [Nouvelles perspectives sur l’IL-12 et l’IL-23 : du mécanisme moléculaire à l’application clinique dans les maladies inflammatoires à médiation immunitaire et les cancers]. Biochem Pharmacol. 2020;175:113928. doi:10.1016/j.bcp.2020.113928
- Silvagni E, Missiroli S, Perrone M, et al. From bed to bench and back: TNF-α, IL-23/IL-17A, and JAK-dependent inflammation in the pathogenesis of psoriatic synovitis [Du lit à la paillasse et retour : les voies TNF-α, IL-23/IL-17A et JAK de l’inflammation dans la pathogénèse du synovite psoriasique]. Front Pharmacol. 2021;12:672515. Published 2021. doi:10.3389/fphar.2021.672515
- Aggarwal BB, Gupta SC, Kim JH. Historical perspectives on tumor necrosis factor and its superfamily: 25 years later, a golden journey [Contexte historique du facteur de nécrose tumorale et de sa superfamille : 25 ans plus tard, un parcours en or]. Blood. 2012;119(3):651-665. doi:10.1182/blood-2011-04-325225
- Croft M, Siegel RM. Beyond TNF: TNF superfamily cytokines as targets for the treatment of rheumatic diseases [Au-delà des TNF : les cytokines de la superfamille des TNF comme cibles du traitement des maladies rhumatismales]. Nat Rev Rheumatol. 2017;13(4):217-233. doi:10.1038/nrrheum.2017.22
- Jang DI, Lee AH, Shin HY, et al. The role of tumor necrosis factor alpha (TNF-α) in autoimmune disease and current TNF-α inhibitors in therapeutics [Le rôle du facteur de nécrose tumorale alpha (TNF-α) dans les maladies auto-immunes et les inhibiteurs actuels du TNF-α dans l’arsenal thérapeutique]. Int J Mol Sci. 2021;22(5):2719. Published 2021. doi:10.3390/ijms22052719
- Holbrook J, Lara-Reyna S, Jarosz-Griffiths H, McDermott M. Tumour necrosis factor signaling in health and disease [La signalisation du facteur de nécrose tumorale dans un contexte de santé et de maladie]. F1000Res. 2019;8:F1000 Faculty Rev-111. Published 2019. doi:10.12688/f1000research.17023.1
- Mantravadi S, Ogdie A, Kraft WK. Inhibiteurs du facteur de nécrose tumorale dans le rhumatisme psoriasique. Expert Rev Clin Pharmacol. 2017;10(8):899-910. doi:10.1080/17512433.2017.1329009
- Lata M, Hettinghouse AS, Liu CJ. Targeting tumor necrosis factor receptors in ankylosing spondylitis [Cibler les récepteurs de facteur de nécrose tumorale dans la spondyloarthrite ankylosante]. Ann N Y Acad Sci. 2019;1442(1):5-16. doi:10.1111/nyas.13933
- Addimanda O, Possemato N, Caruso A, et al. The role of tumor necrosis factor-α blockers in psoriatic disease. Therapeutic Options in Psoriatic Arthritis [Le rôle des anti-TNF-α dans les maladies psoriasiques. Options thérapeutiques dans le rhumatisme psoriasique]. J Rheumatol Suppl. 2015;93:73-78. doi:10.3899/jrheum.150642
- Liu J, Dong Z, Zhu Q, et al. TNF-α promoter polymorphisms predict the response to etanercept more powerfully than that to infliximab/adalimumab in spondyloarthritis [Les polymorphismes du promoteur du TNF-α sont un facteur prédictif plus puissant de la réponse à l’étanercept que de celle de l’infliximab/adalimumab dans la spondylarthrite]. Sci Rep. 2016;6:32202. Published 2016. doi:10.1038/srep32202
- Noack M, Beringer A, Miossec P. Additive or synergistic interactions between IL-17A or IL-17F and TNF or IL-1β depend on the cell type [L’effet additif ou synergique des interactions entre l’IL-17A ou l’IL-17F et un TNF ou l’IL-1β dépend du type de cellule]. Front Immunol. 2019;10:1726. Published 2019. doi:10.3389/fimmu.2019.01726
- McInnes IB, Szekanecz Z, McGonagle D, et al. A review of JAK-STAT signaling in the pathogenesis of spondyloarthritis and the role of JAK inhibition [Une analyse de la signalisation JAK-STAT dans la pathogénèse des spondylarthrites et du rôle de l’inhibition des JAK] [publié en ligne avant impression, 2021]. Rheumatology (Oxford). 2021;keab740. doi:10.1093/rheumatology/keab740
- White JPE, Coates LC. JAK1 selective inhibitors for the treatment of spondyloarthropathies [Inhibiteurs sélectifs de JAK1 pour le traitement des spondyloarthrites]. Rheumatology (Oxford). 2021;60(Suppl 2):ii39-ii44. doi:10.1093/rheumatology/keaa815
- Fragoulis GE, McInnes IB, Siebert S. JAK-inhibitors. New players in the field of immune-mediated diseases, beyond rheumatoid arthritis [Nouveaux acteurs dans le domaine des maladies à médiation immunitaire, au-delà de la polyarthrite rhumatoïde]. Rheumatology (Oxford). 2019;58(Suppl 1):i43-i54. Published 2019. doi: 10.1093/rheumatology/key276.
- Kilanowska A, Ziółkowska A. Role of phosphodiesterase in the biology and pathology of diabetes [Rôle de la phosphodiestérase dans la biologie et pathobiologie du diabète]. Int J Mol Sci. 2020;21(21):8244. Published 2020. doi:10.3390/ijms21218244
- Li H, Zuo J, Tang W. Phosphodiesterase-4 inhibitors for the treatment of inflammatory diseases [Inhibiteurs de la phosphodiestérase-4 pour le traitement de maladies inflammatoires]. Front Pharmacol. 2018;9:1048. Published 2018. doi:10.3389/fphar.2018.01048