Explorez le rôle de la famille IL-17 dans la SpA et les maladies inflammatoires à médiation immunitaire
IL-17 = interleukine 17; SpA = spondyloarthrite
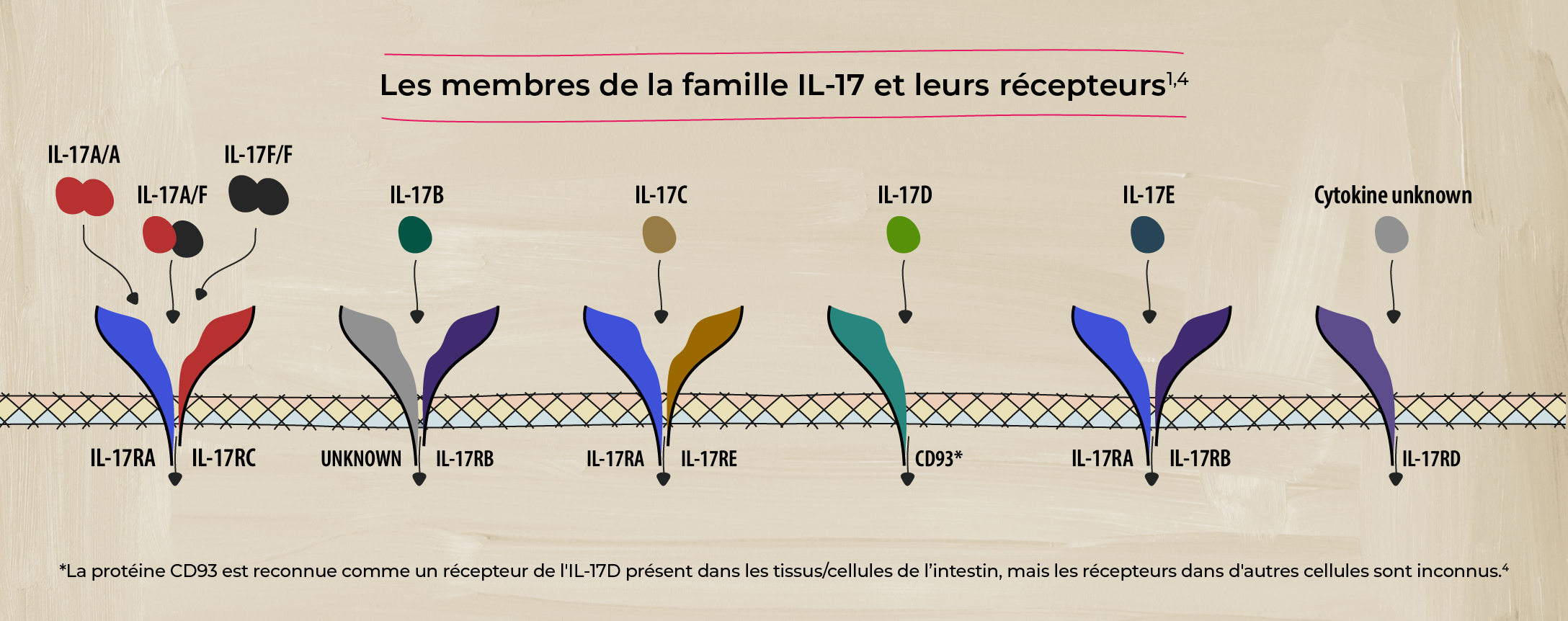
La famille des cytokines IL-17
La famille des cytokines IL-17 se compose de six molécules de signalisation structurellement apparentées (IL-17A, IL-17B, IL-17C, IL-17D, IL-17E, et IL-17F) qui jouent un rôle important dans le système immunitaire.1
Les cytokines IL-17 sont sécrétées par un sous-ensemble de cellules T auxiliaires appelées Th17, qui sont principalement induites par l'IL-23.2 Cependant, on sait que l'IL-17 est également exprimée par d'autres cellules immunitaires adaptatives et innées, qui peuvent être activées indépendamment de l'IL-23 par des cytokines telles que l'IL-1β, l'IL-12 et l'IL-18.2-4
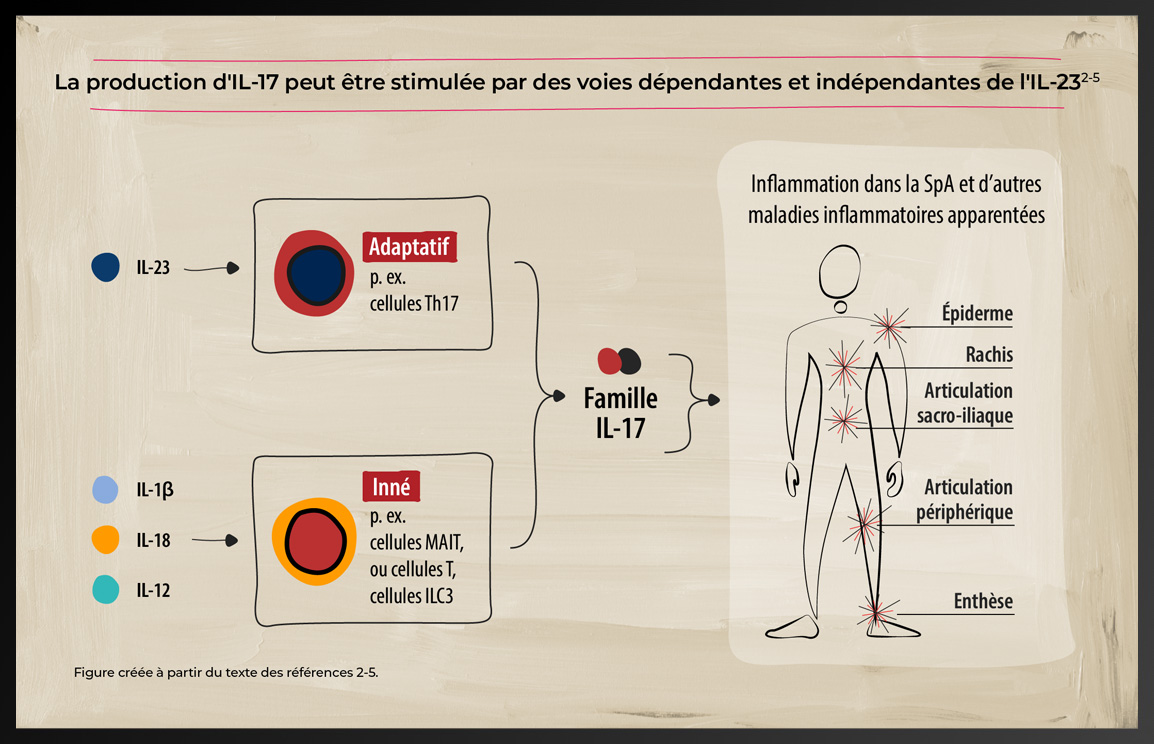
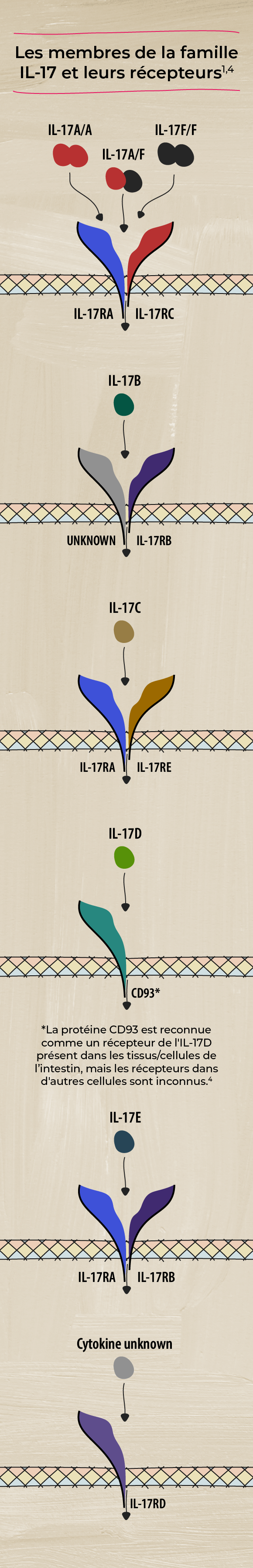
La plupart des membres de la famille IL-17 fonctionnent en paires, composées de deux molécules identiques (homodimères), mais l'IL-17A et l'IL-17F peuvent fonctionner à la fois comme homodimères (IL-17A/A et IL-17F/F) et comme hétérodimères (IL-17A/F).1
Chaque cytokine IL-17 se lie à un ou plusieurs récepteurs à la surface des cellules cibles, l'IL-17A et l'IL-17F émettant des signaux par l'intermédiaire du même complexe récepteur. Lorsqu'une molécule d'IL-17 se lie à son récepteur, elle déclenche une série de réactions à l'intérieur de la cellule, entraînant des changements dans le comportement ou la fonction de la cellule. Comme l'IL-17A et l'IL-17F partagent le même complexe récepteur, leurs rôles se chevauchent.1,2,4
Comprendre le rôle de la famille des cytokines IL-17 dans la maladie
Les cytokines de la famille IL-17 participent à la régulation de nombreuses réponses immunitaires et jouent un rôle clé dans la santé et la maladie. Ils ont été fortement liés à la pathogenèse de nombreuses maladies rhumatismales, y compris l'axSpA et le RP.3,5
En savoir plus sur le rôle des cytokines IL-17 dans la maladie
-

IL-17A3-7 | IL-17F3-7
- RP, axSpA
- PR, LED, PP, HS
- Autres (cancer, obésité, asthme, SEP)
-

IL-17B5
- Arthrite inflammatoire (PR)
- LED
- Cancer
-

IL-17C5,8,9
- PP, HS, LED
- MII
- Cancer
- Maladie rénale
-
IL-17D5,10
- PR
- Cancer
- Septicémie
-
IL-17E2,5
- PP
- Réactions allergiques (asthme)
Rôle des cytokines IL-17 dans la SpA
Le rôle de l'IL-17A et de l'IL-17F dans l’apparition de la spondylarthrite ankylosante est bien établi. Il existe de nouvelles preuves du rôle des IL-17B, IL-17C, IL-17D et IL-17E dans les maladies inflammatoires à médiation immunitaire; toutefois, leur rôle dans la spondylarthrite ankylosante n'a pas encore été élucidé.3-10
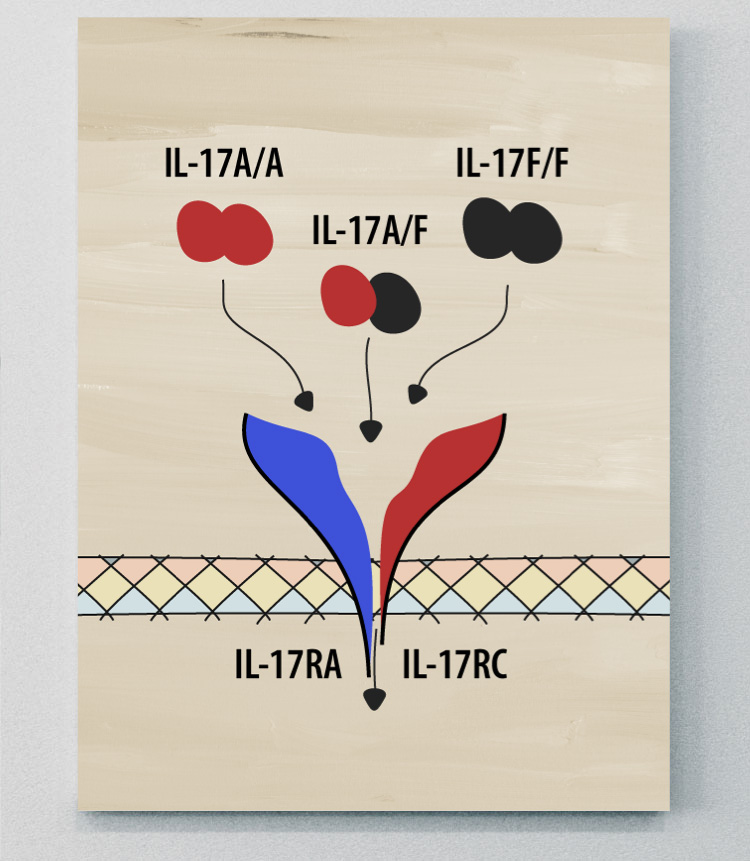
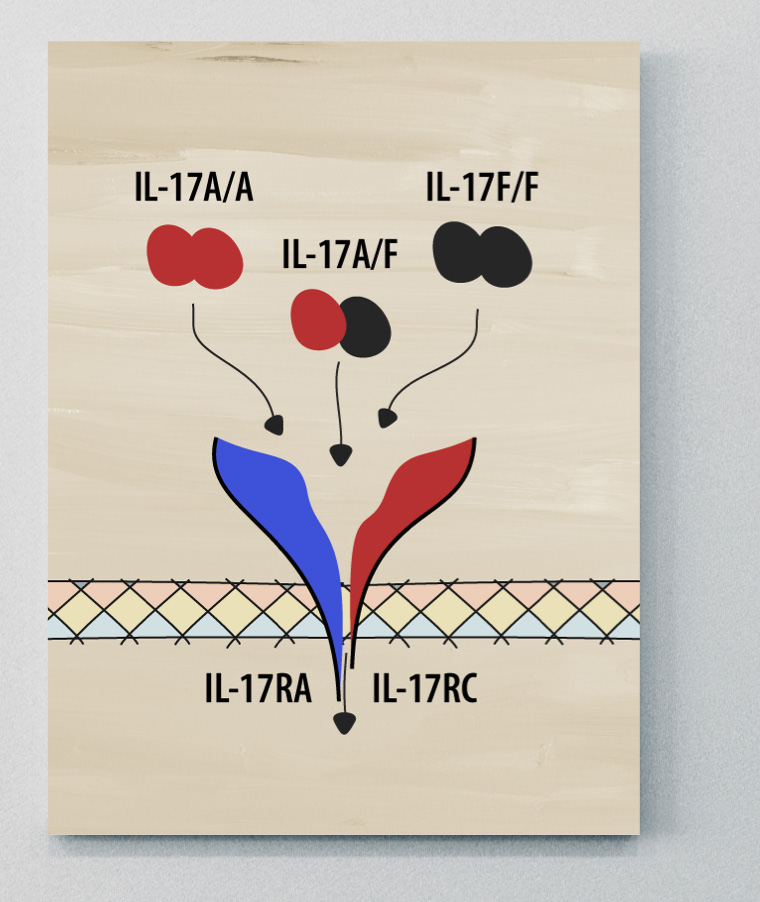
IL-17A et IL-17F
Des études indiquent que l'activité biologique et les rôles de l'IL-17A et de l'IL-17F sont similaires et que des fonctions distinctes de l'IL-17F au-delà de celles de l'IL-17A n'ont pas été établies à ce jour.1,3
L'IL-17A et l'IL-17F sont toutes deux des médiateurs des réponses pro-inflammatoires en aval dans la spondylarthrite ankylosante; cependant, leurs rôles peuvent différer selon les différents foyers d'inflammation.11
Ces différences peuvent être dues à des écarts entre les taux d'expression observés dans les différentes régions du corps, à une régulation différentielle et à des variations de la puissance.11 Par exemple, bien que l'IL-17F soit présente à des concentrations plus élevées (jusqu'à 30 fois) dans la peau lésée et le sérum des patients atteints de PP, l'IL-17A a un effet pro-inflammatoire plus puissant.3
L'expression de l'IL-17A et de l'IL-17F diffère selon les foyers d'inflammation
-

Os
(axSpA et SpA)- L'IL-17A et l'IL-17F sont aussi efficaces l’une que l’autre pour promouvoir la différenciation ostéogénique11,12
- Les IL-17A et IL-17F peuvent favoriser la prolifération osseuse dans la SA11,12
-

Enthèse périphérique
et axiale- L'IL-17F était plus fortement exprimée que l'IL-17A dans le sang périphérique et l'enthèse13
- L'IL-17A et l'IL-17F sont produites par les cellules T dans les enthèses et agissent en synergie avec le TNF14
-

Peau
(PP)- L'expression de l'IL-17F est plus marquée que celle de l'IL-17A dans la peau lésée des patients atteints de PP, mais l'IL-17A a un effet plus puissant11
-

Articulation
(axSpA et RP)- L'expression de l'IL-17A est plus forte que celle de l'IL-17F dans la synovite associée à la SpA11
- L'expression de l'IL-17F (mais pas celle de l'IL-17A) est importante dans le tissu synovial dans les cas de RP par rapport à l'arthrose15
Résumé des résultats des études précliniques et translationnelles.
Des études suggèrent que l'IL-17A et l'IL-17F sont des catalyseurs de l'inflammation et de la formation de nouveaux os12,16-18
Les IL-17A et IL-17F collaborent séparément avec le TNF pour déclencher l'inflammation en amplifiant la production d'IL-6 et d'IL-8 dans les synoviocytes16,17
Les IL-17A et IL-17F stimulent la différenciation ostéogénique des cellules souches mésenchymateuses humaines*12,18

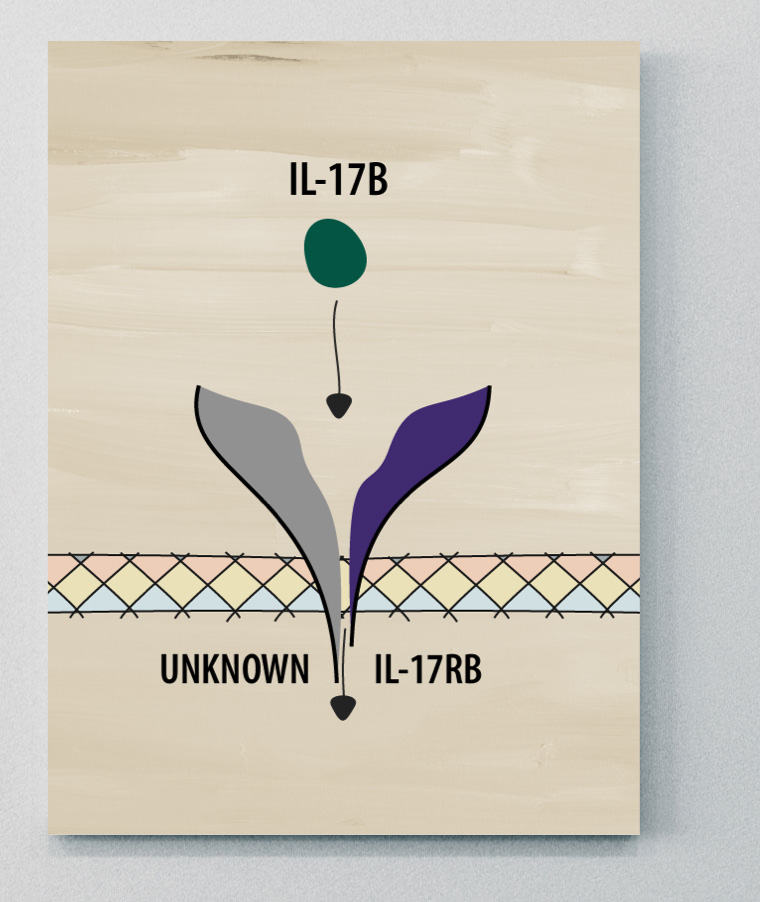
IL-17B
L'IL-17B est un médiateur des réponses pro- et anti-inflammatoires. Le rôle de l'IL-17B dans la SA reste à élucider; cependant, l'IL-17B joue un rôle dans le déclenchement de diverses maladies inflammatoires à médiation immunitaire, notamment la PR et le LED.2,5
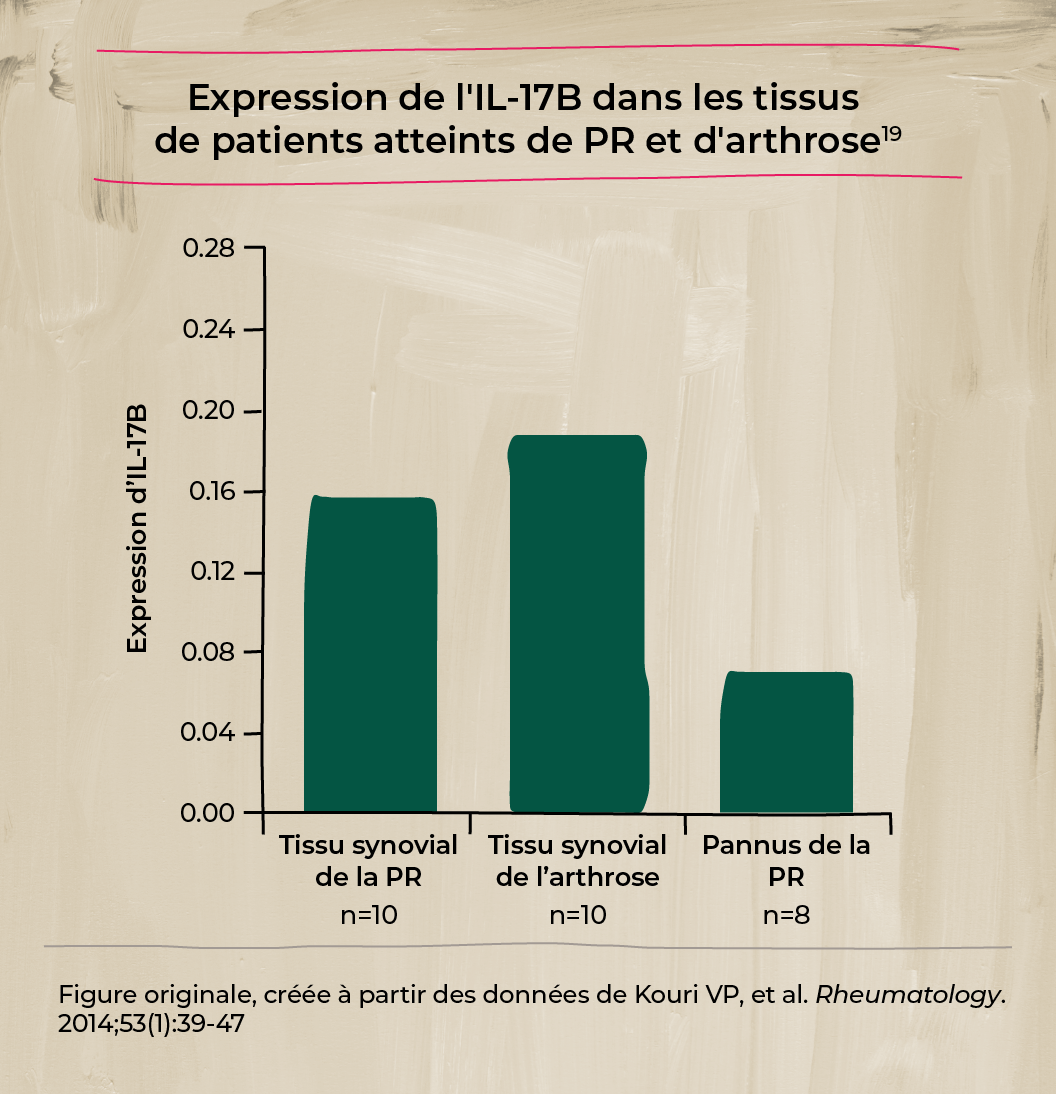
L'IL-17B est la principale cytokine de la famille IL-17 dans les tissus de la PR et de l'arthrose19
- Dans l’atteinte du tissu synovial de la PR, l'expression de l'IL-17B était significativement plus forte que celle de l'IL-17D, de l'IL-17E et de l'IL-17F (p < 0,05)19
- Dans le tissu synovial de l’arthrose et le pannus de la PR, l’expression de l’IL-17B étaient significativement plus marquée que celle de toutes les autres cytokines IL-17 évaluées, y compris l’IL-17A, l’IL-17C, l’IL-17D, l’IL-17E et l’IL-17F (p < 0,05)19
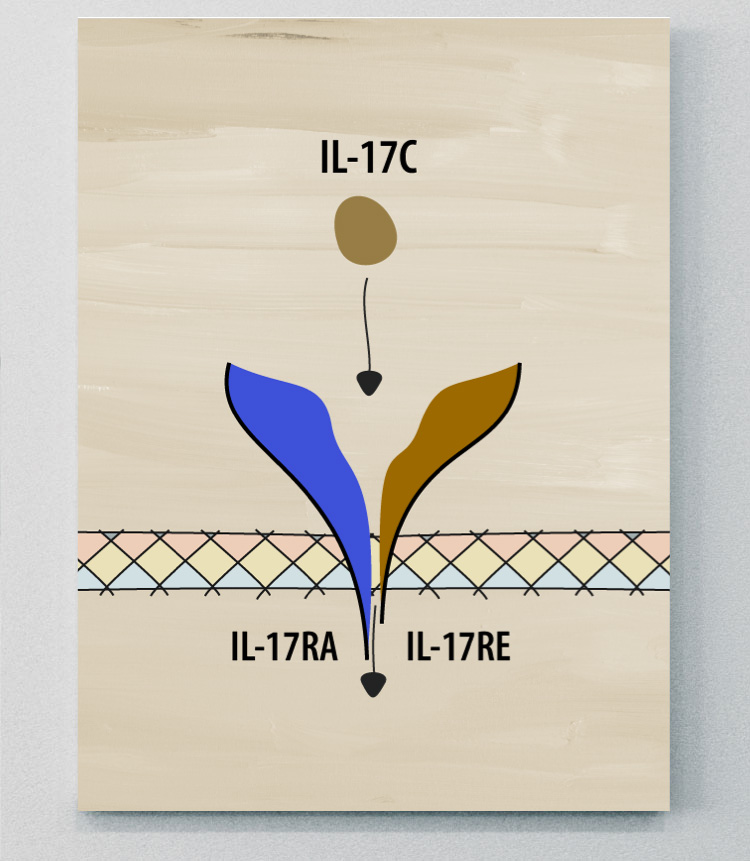
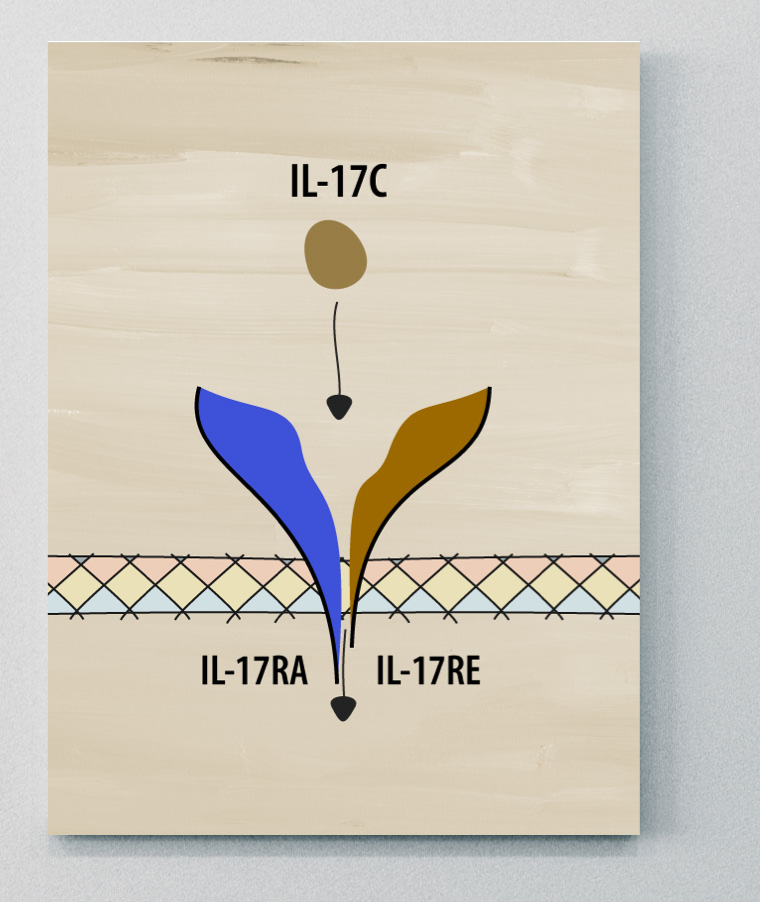
IL-17C
L'IL-17C intervient dans les réponses pro- et anti-inflammatoires. L'inflammation provoquée par l'IL-17C est souvent liée à la peau.2
L'IL-17C a été associée à la pathogenèse du PP de l'HS et des MII, ainsi que de plusieurs autres maladies et affections. Toutefois, le rôle de l'IL-17C dans la spondylarthrite ankylosante reste à élucider.2,5,8,9
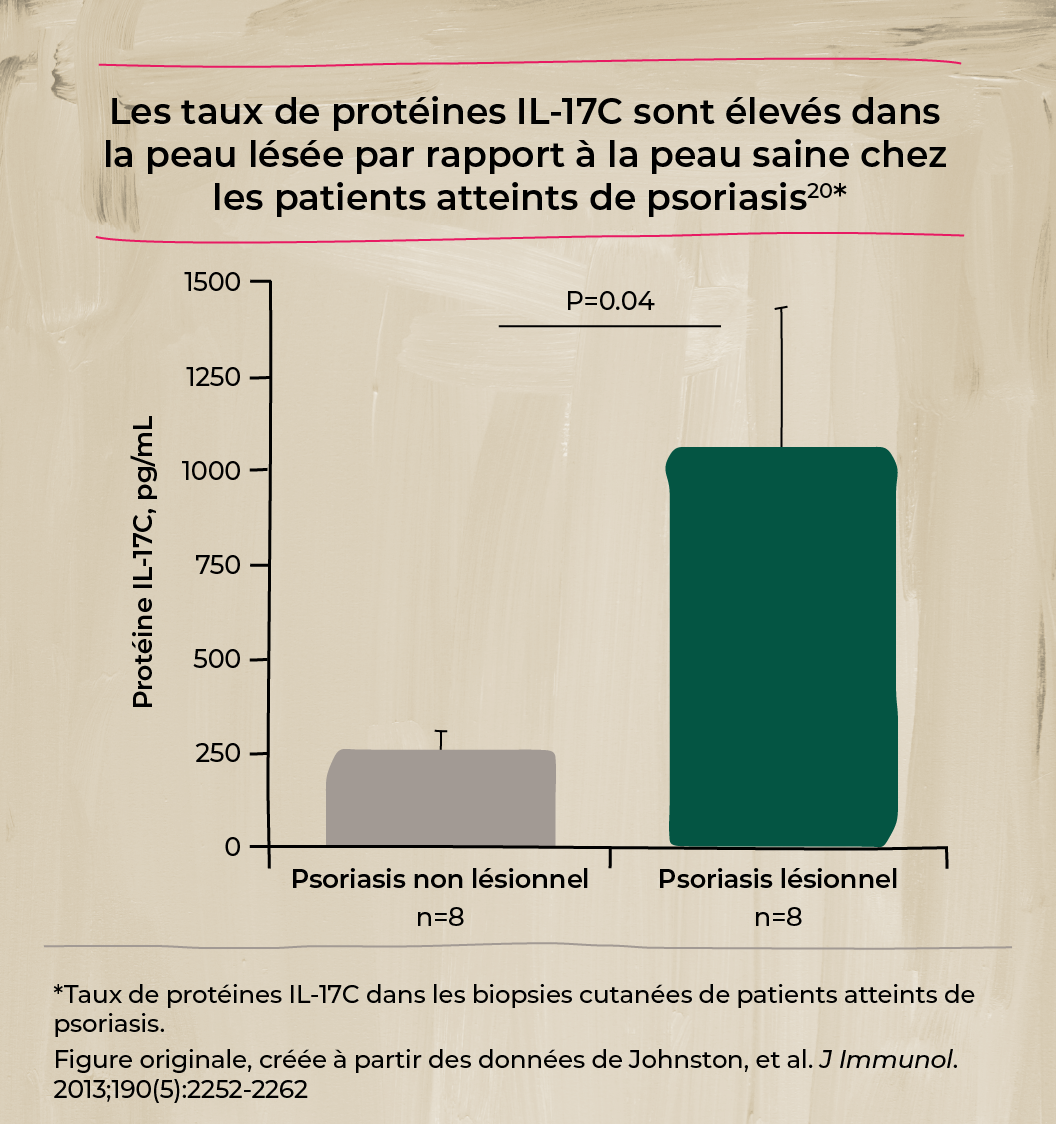
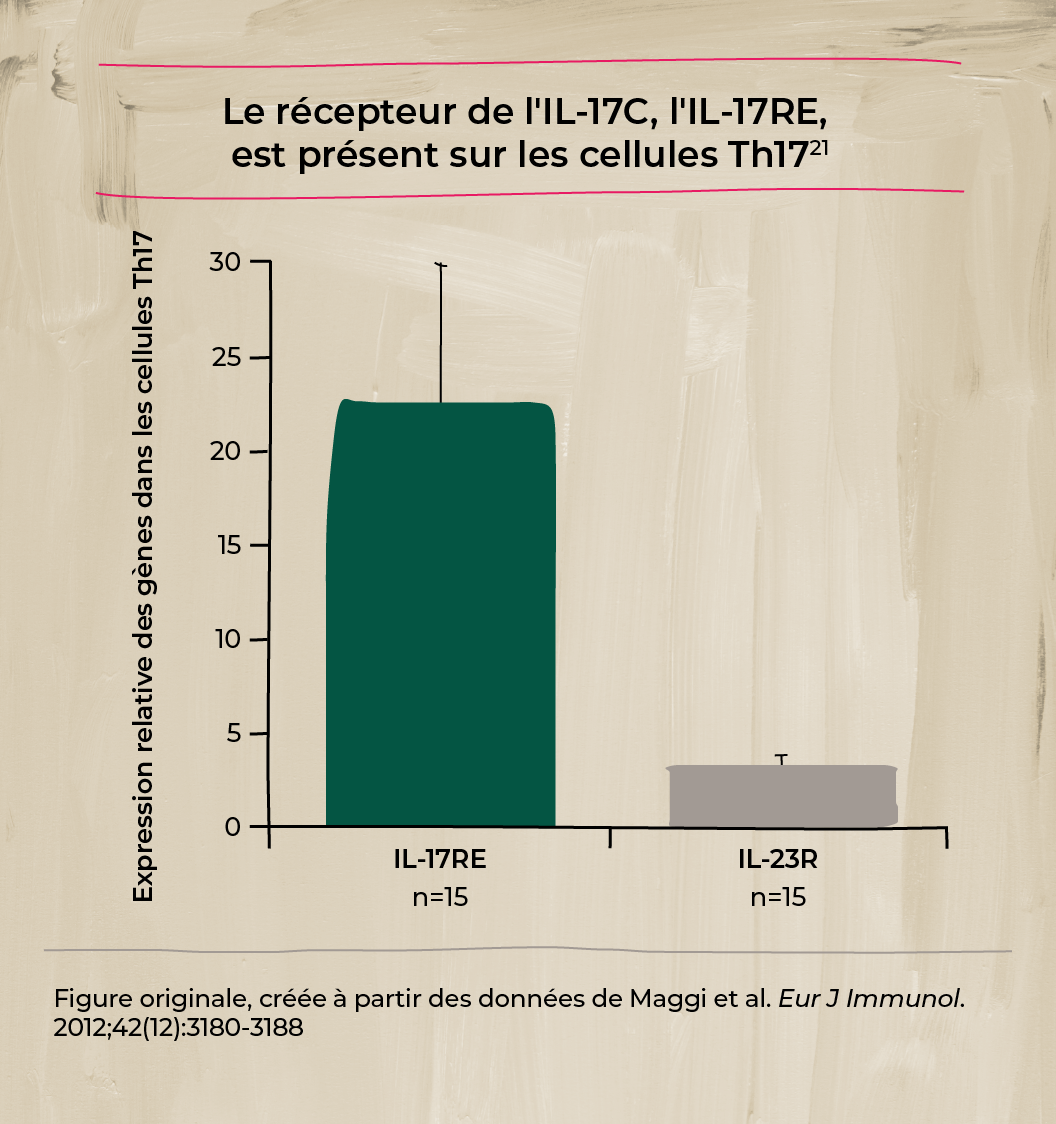
Le rôle de l'IL-17C et de son récepteur dans la peau et l'inflammation20,21
Des études ont montré que l'IL-17C est exprimée par les kératinocytes activés dans la peau psoriasique et agit sur son récepteur sur les cellules Th17 pour propager l'inflammation.20,21
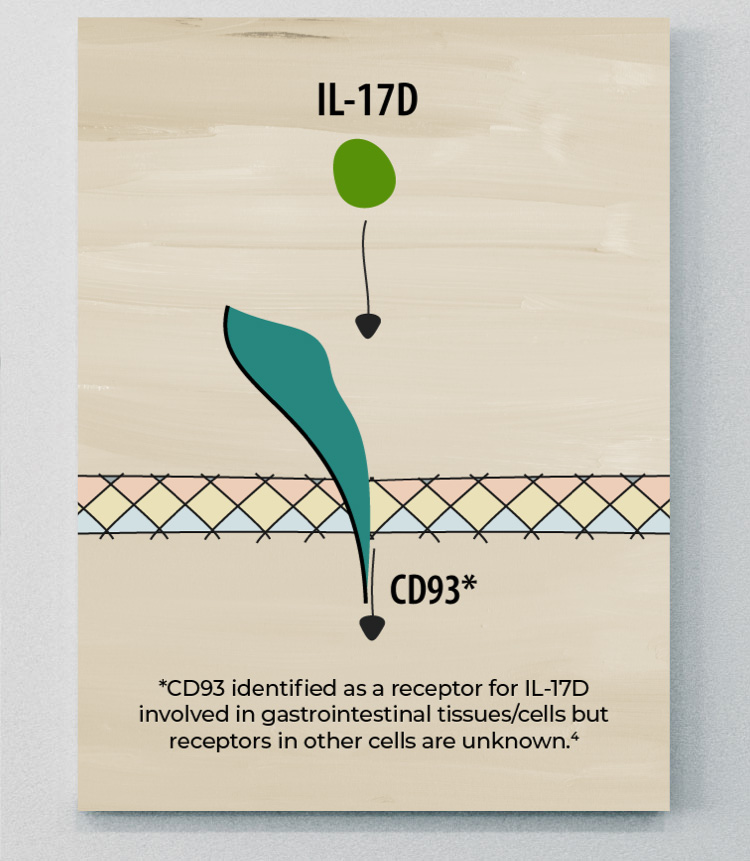
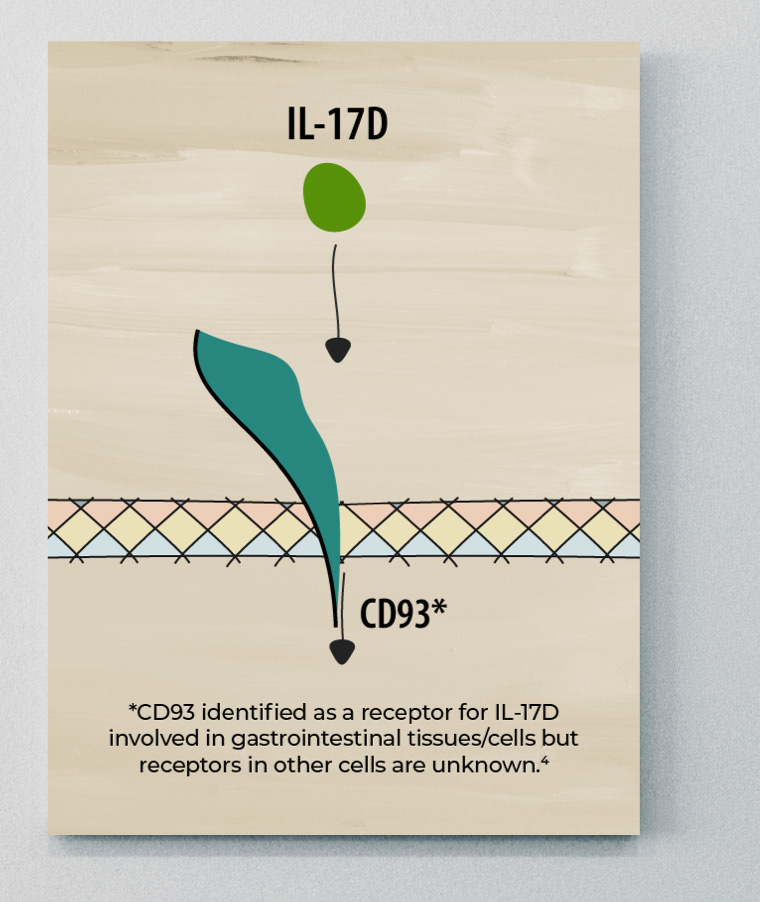
IL-17D
L'IL-17D est le membre de la famille IL-17 le moins bien étudié, et ses sources cellulaires et fonctions biologiques demeurent largement inconnues. Cependant, certaines données portent à croire que l'IL-17D pourrait jouer un rôle protecteur dans la SpA.11

Des études laissent entendre que l'IL-17D pourrait également jouer un rôle pro-inflammatoire dans la maladie. En culture, le traitement par l'IL-17D stimule la production des cytokines IL-6 et IL-8, ce qui laisse entrevoir un rôle potentiel dans la médiation de l'inflammation.23
Bien que certaines données donnent à penser que l'IL-17D pourrait avoir un rôle à la fois pro- et anti-inflammatoire, son rôle pathogène dans la maladie n'est pas clair.3
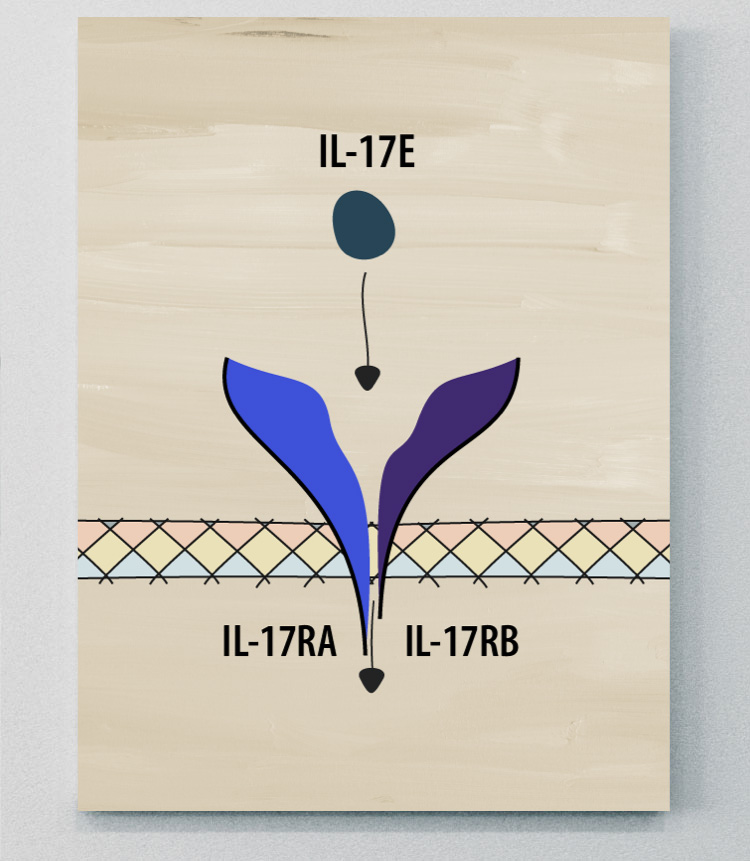
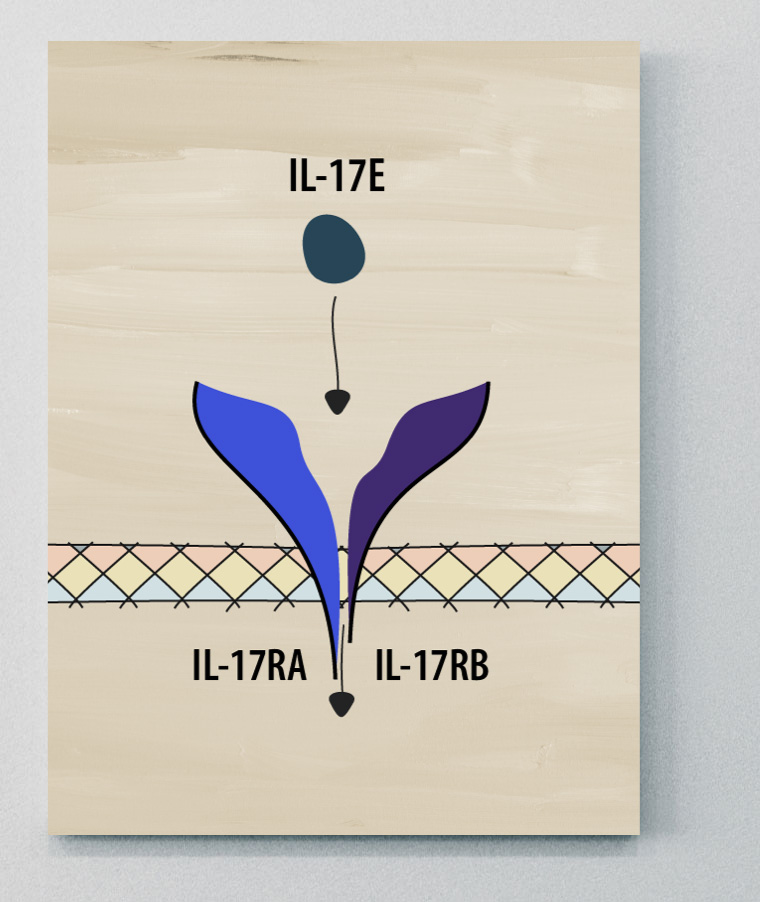
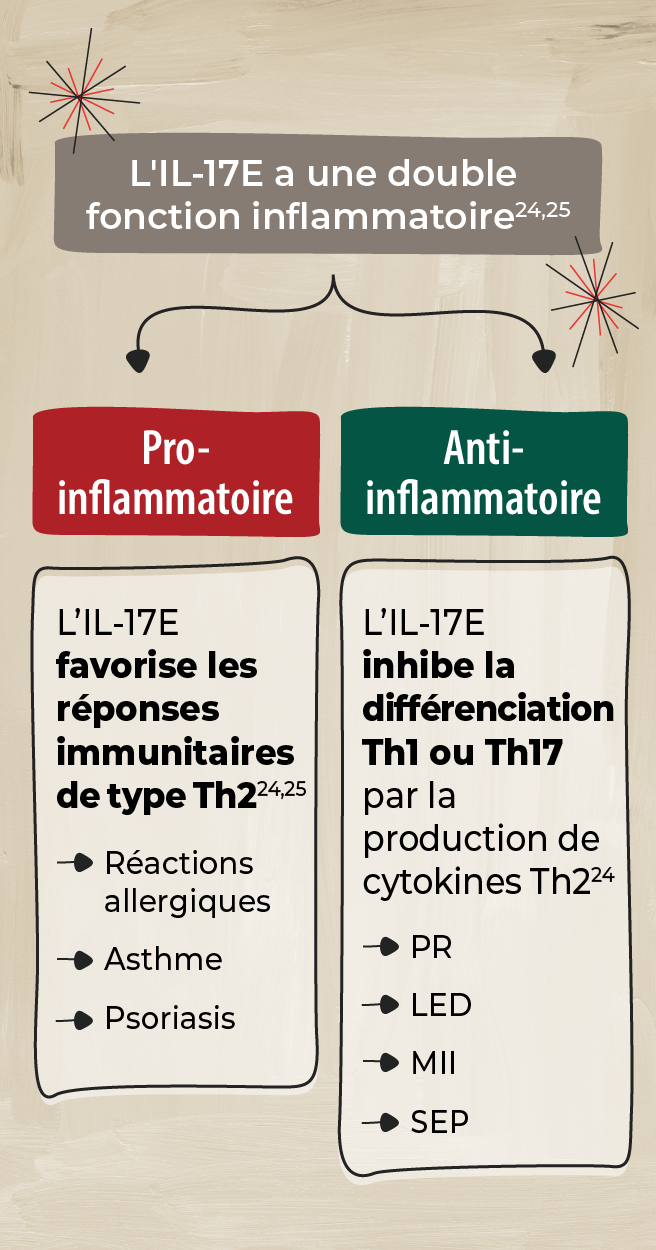
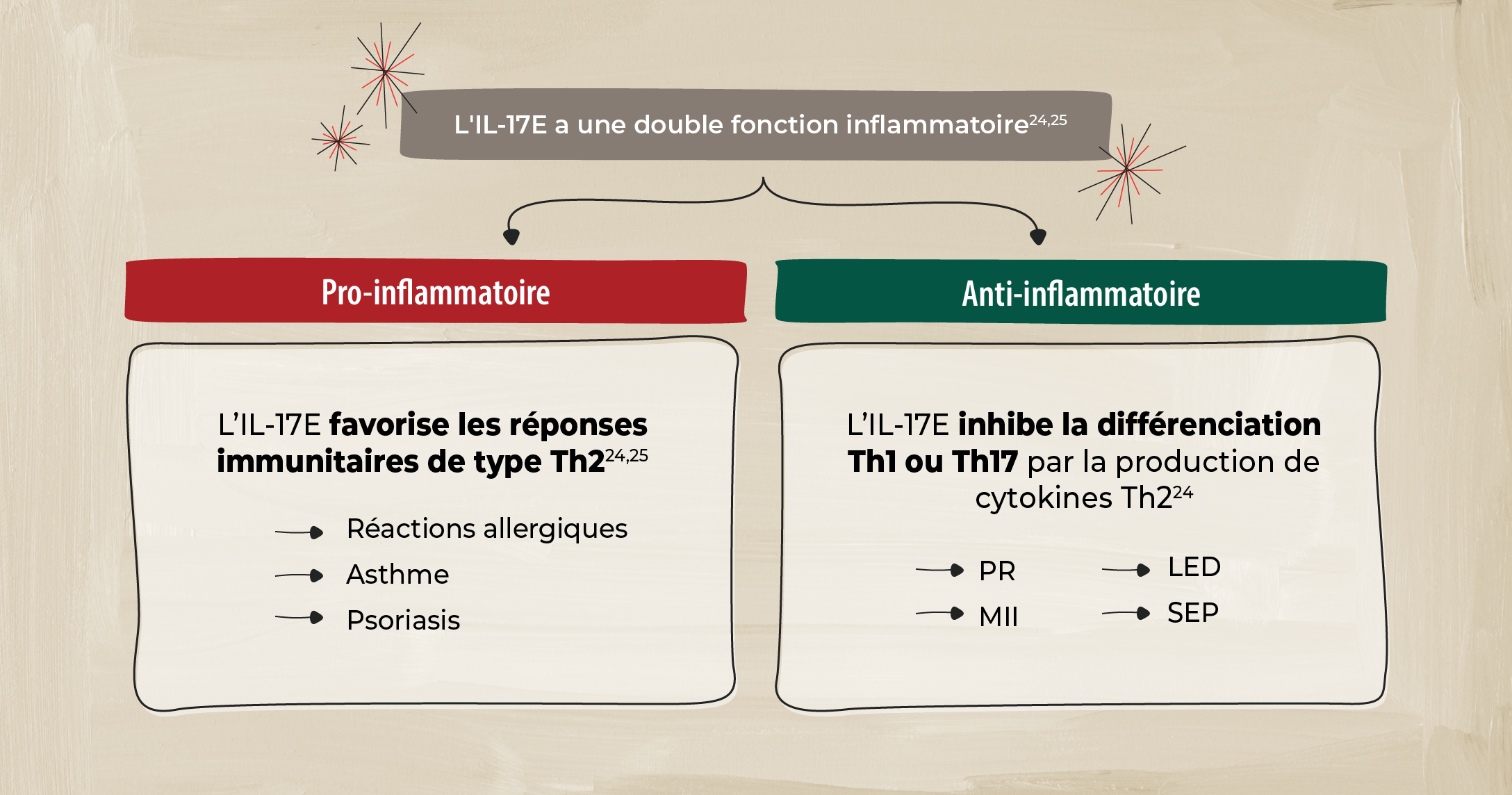
IL-17E
L'IL-17E diffère des autres membres de la famille IL-17, car elle favorise une immunité de type 2 (associée à l’apparition de réactions allergiques) et joue divers rôles dans différents tissus. 24
L'IL-17E joue un rôle pro-inflammatoire dans les maladies à médiation par Th2 et un rôle anti-inflammatoire dans d'autres maladies. Toutefois, le rôle de l'IL-17C dans la SpA reste à élucider. 24
Examiner les implications cliniques de la famille IL-17
L'IL-17A et l'IL-17F ont un rôle établi dans le déclenchement de la SpA. Bien que leurs fonctions se chevauchent, IL-17A et de l'IL-17F pourraient exercer des effets différents selon les foyers d'inflammation dans la maladie.11
Le rôle des autres membres de la famille IL-17 (notamment IL-17B, IL-17C, IL-17D et IL-17E) dans la SpA est en grande partie inconnu; cependant, ils sont apparus comme des facteurs clés dans d'autres IMID.3,6
Les recherches futures sur les cytokines IL-17 pourraient contribuer à des avancées thérapeutiques dans la SpA et dans de nombreuses autres maladies.
IMID = maladie inflammatoire à médiation immunitaire.
Découvrez les mécanismes pathologiques des spondylarthrites (SpA), notamment le rôle des IL-17A, IL-17F, TNF et IL-23
Visitez l'exposition sur la biopathologie de l'axSpA ou du RP pour découvrir les mécanismes à l'origine de la SpA
- Brembilla NC, Senra L, Boehncke WH. The IL-17 family of cytokines in psoriasis: IL-17A and beyond. Front Immunol. 2018;9:1682. doi:10.3389/fimmu.2018.01682
- Meehan EV, Wang K. Interleukin-17 family cytokines in metabolic disorders and cancer. Genes (Basel). 2022;13(9):1643. doi:10.3390/genes13091643
- Navarro-Compán V, Puig L, Vidal S, et al. The paradigm of IL-23-independent production of IL-17F and IL-17A and their role in chronic inflammatory diseases. Front Immunol. 2023;14:1191782. doi:10.3389/fimmu.2023.1191782
- Chung SH, Ye XQ, Iwakura Y. Interleukin-17 family members in health and disease. Int Immunol. 2021;33(12):723-729. doi:10.1093/intimm/dxab075
- Davydova A, Kurochkina Y, Goncharova V, et al. The interleukine-17 cytokine family: role in development and progression of spondyloarthritis, current and potential therapeutic inhibitors. Biomedicines. 2023;11(5):1328. doi:10.3390/biomedicines11051328
- McGeachy MJ, Cua DJ, Gaffen SL. The IL-17 family of cytokines in health and disease. Immunity. 2019;50(4):892-906. doi:10.1016/j.immuni.2019.03.021
- Koga T, Ichinose K, Kawakami A, et al. Current insights and future prospects for targeting IL-17 to treat patients with systemic lupus erythematosus. Front Immunol. 2021;11:624971. doi:10.3389/fimmu.2020.624971
- Fletcher JM, Moran B, Petrasca A, Smith CM. IL-17 in inflammatory skin diseases psoriasis and hidradenitis suppurativa. Clin Exp Immunol. 2020;201(2):121-134. doi:10.1111/cei.13449
- Nies JF, Panzer U. IL-17C/IL-17RE: emergence of a unique axis in TH17 biology. Front Immunol. 2020;11:341. doi:10.3389/fimmu.2020.00341
- Liu X, Sun S, Liu D. IL-17D: a less studied cytokine of IL-17 family. Int Arch Allergy Immunol. 2020;181(8):618-623. doi:10.1159/000508255
- Yeremenko N. Out of the shadow of interleukin-17A: the role of interleukin-17F and other interleukin-17 family cytokines in spondyloarthritis. Curr Opin Rheumatol. 2021;33(4):333-340. doi:10.1097/BOR.0000000000000805
- Wang R, Maksymowych WP. Targeting the interleukin-23/interleukin-17 inflammatory pathway: successes and failures in the treatment of axial spondyloarthritis. Front Immunol. 2021;12:715510. doi:10.3389/fimmu.2021.715510
- Mcdermott N, Macleod T, Rao AS, et al. AB0011 cytometric analysis of activated entheseal tissue resident T-cells reveals IL-17F as the dominant IL-17 isoform expressed by innate and adaptive lymphocytes. Annals of the Rheumatic Diseases. 2023;82:1184-1185
- Bridgewood C, Russell T, Watad A, et al. THU0013 IL-17A and IL-17F are secreted by enthesis T cells and synergize with TNF to induce CCL20 from entheseal stromal cells. Annals of the Rheumatic Diseases. 2019;78:274
- Taams LS, Steel KJA, Srenathan U, et al. IL-17 in the immunopathogenesis of spondyloarthritis. Nat Rev Rheumatol. 2018;14(8):453-466. doi:10.1038/s41584-018-0044-2
- Sánchez-Rodríguez G, Puig L. Pathogenic role of IL-17 and therapeutic targeting of IL-17F in psoriatic arthritis and spondyloarthropathies. Int J Mol Sci. 2023;24(12):10305. doi:10.3390/ijms241210305
- Noack M, Beringer A, Miossec P. Additive or synergistic interactions between IL-17A or IL-17F and TNF or IL-1β depend on the cell type. Front Immunol. 2019;10:1726. doi:10.3389/fimmu.2019.01726
- Croes M, Öner FC, van Neerven D, et al. Proinflammatory T cells and IL-17 stimulate osteoblast differentiation. Bone. 2016;84:262-270. doi:10.1016/j.bone.2016.01.010
- Kouri VP, Olkkonen J, Ainola M, et al. Neutrophils produce interleukin-17B in rheumatoid synovial tissue. Rheumatology (Oxford). 2014;53(1):39-47. doi:10.1093/rheumatology/ket309
- Johnston A, Fritz Y, Dawes SM, et al. Keratinocyte overexpression of IL-17C promotes psoriasiform skin inflammation. J Immunol. 2013;190(5):2252-2262. doi:10.4049/jimmunol.1201505
- Maggi L, Santarlasci V, Capone M, et al. Distinctive features of classic and nonclassic (Th17 derived) human Th1 cells. Eur J Immunol. 2012;42(12):3180-3188. doi:10.1002/eji.201242648
- Chen S, Manning C, van Tok M, et al. Interleukin-17D, a cytokine derived from stromal cells, attenuates joint inflammation [abstract]. Arthritis Rheumatol. 2020;72(suppl 10). Accessed March 2024. https://acrabstracts.org/abstract/interleukin-17d-a-cytokine-derived-from-stromal-cells-attenuates-joint-inflammation/
- Starnes T, Broxmeyer HE, Robertson MJ, et al. Cutting edge: IL-17D, a novel member of the IL-17 family, stimulates cytokine production and inhibits hemopoiesis. J Immunol. 2002;169(2):642-646. doi:10.4049/jimmunol.169.2.642
- Deng C, Peng N, Tang Y, et al. Roles of IL-25 in type 2 inflammation and autoimmune pathogenesis. Front Immunol. 2021;12:691559. doi:10.3389/fimmu.2021.691559
- Fort MM, Cheung J, Yen D, et al. IL-25 induces IL-4, IL-5, and IL-13 and Th2-associated pathologies in vivo. Immunity. 2001;15(6):985-995. doi:10.1016/s1074-7613(01)00243-6