

Étudiez comment la dysrégulation immunitaire conduit à l’inflammation chez les patients atteints d’axSpA
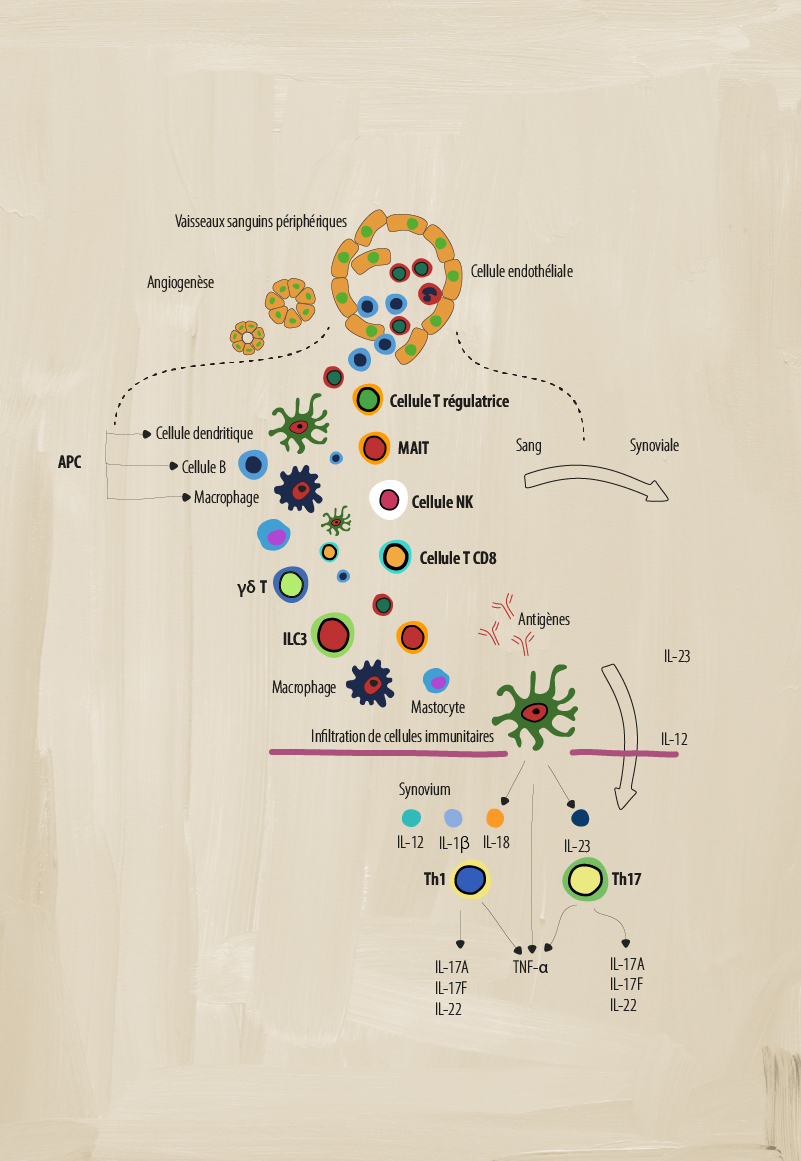
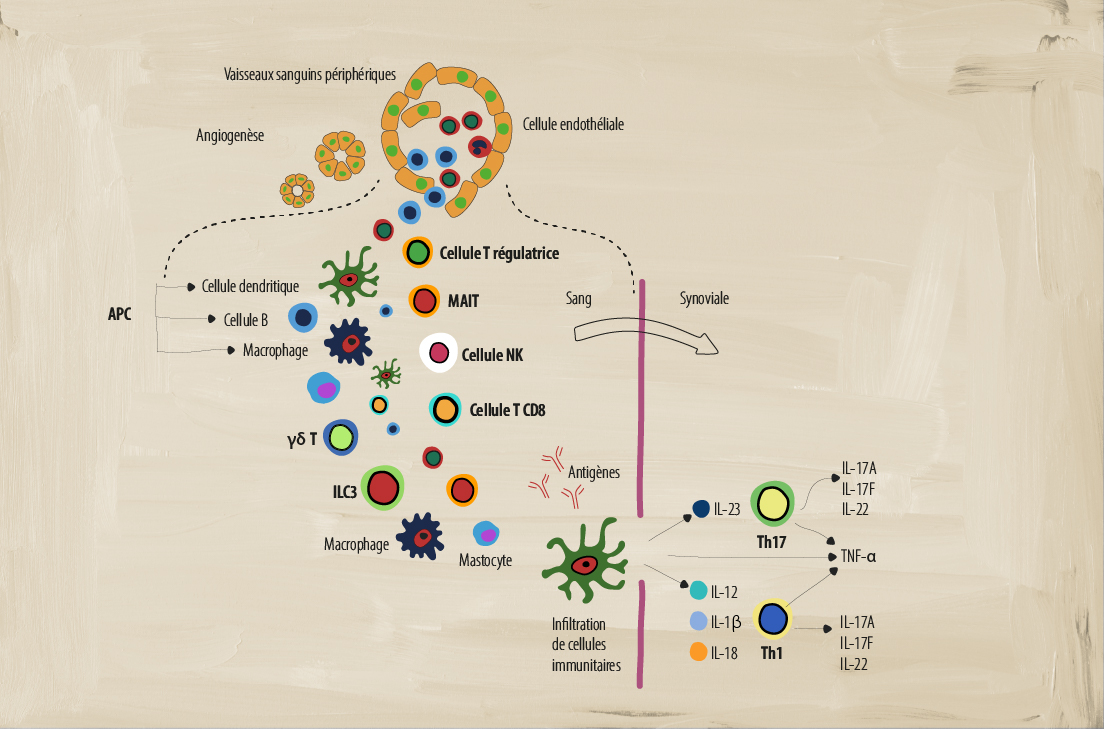
Le rôle de différentes cellules immunitaires dans l’axSpA
Un système immunitaire déréglé comporte de nombreuses parties mobiles qui agissent pour créer l’inflammation chronique indiquant la pathologie de la SpA. Plusieurs types de cellules immunitaires adaptatives et innées jouent un rôle clé dans la médiation de l’inflammation.1-4
Téléchargez une clé pour vous guider dans la lecture de chaque pièce
- Inné
- Adaptatif
Cellules présentatrices d’antigène (CPA)
Qu’est-ce que c’est? Les CPA comprennent les cellules B, les macrophages et les cellules dendritiques (CD) qui participent à l’immunité cellulaire. Elles traitent et présentent les antigènes pour qu’ils soient reconnus par d’autres éléments du système immunitaire, tels que les cellules T.5
Rôle dans la SpA :
Les cellules dendritiques activent la réponse immunitaire adaptative en stimulant les réponses inflammatoires des Th1 et Th2, alors que les CD issues de monocytes sont impliquées dans les voies de signalisation dérégulées qui provoquent des réponses inflammatoires dans les cellules Th17.2 Il semble que les cytokines IL-23 et IL-12 sécrétées par les CD activent la différenciation des sous-ensembles Th17 et Th1 de cellules T.4
Les macrophages peuvent produire des niveaux élevés de nombreuses cytokines pro-inflammatoires, telles que l’IL-12, l’IL-6, l’IL-23 et le TNF-α, qui perpétuent l’inflammation chronique.4 Par exemple, les macrophages activés produisent l’IL-23, qui favorise la différenciation des cellules TH17.4 Ces cellules se retrouvent en plus grand nombre dans la synoviale et les enthèses, qui sont en corrélation avec l’activité de la maladie SpA.2
Cellules T gamma-delta (γẟ T)
Qu’est-ce que c’est? Un sous-groupe de cellules T dont la surface présente des chaînes distinctes de récepteurs de cellules T (TCR) γ et δ qui agissent de manière innée. Elles sont connues pour leur reconnaissance sans restriction d’antigène du CMH et leur sécrétion abondante de cytokines, certains sous-ensembles produisant de l’IL-17 en l’absence d’activation du TCR.7
Rôle dans la SpA : La SpA est caractérisée par une augmentation de cellules T γδ T productrices d’IL-23+, fortement orientées vers la production d’IL-17 en réponse à l’IL-23 ou à la signalisation anti-CD3/CD28.7 On a également constaté une augmentation des cellules γδ T doublement productrices d’IL-17 et de GM-CSF dans le sang périphérique des patients atteints de SpA.7
CMH = complexe majeur d’histocompatibilité.
Cellules lymphoïdes innées de type 3 (ILC3)
Qu’est-ce que c’est? Des cellules effectrices du système immunitaire inné qui n’ont pas les récepteurs d'antigènes issus de réarrangement génétique normalement exprimés par les cellules adaptatives. Localisées principalement dans les tissus périphériques, elles sont activées en réponse à un stress environnemental et sont impliquées dans le remodelage tissulaire, la défense contre les pathogènes et la régulation de l’homéostasie.6
Rôle dans la SpA : Les cellules ILC3 sont similaires aux cellules Th17 et produisent les IL-17, IL-22 et GM-CSF. Dans la SpA, le nombre de cellules ILC3 augmente et, en réponse à l’IL-23 et l’IL-1b, elles produisent des cytokines IL-17, ce qui potentialise plus encore l’état pro-inflammatoire des divers sites de manifestation clinique (par ex. enthèses).6
Cellules T régulatrices
Qu’est-ce que c’est? Une sous-population de cellules T capables de réguler et de supprimer la réponse immunitaire, et de jouer un rôle crucial dans le maintien de l’autotolérance par l’inhibition de l’activation/prolifération des cellules T ainsi que de la production de cytokines.9
Rôle dans la SpA : Le rôle des Treg dans la SpA fait encore l’objet de débats. Certaines études ont montré des pourcentages plus faibles de cellules Treg et une fonction Treg altérée dans le sang périphérique des patients atteints de SA, ce qui pourrait représenter un déséquilibre entre les cellules Treg et la réponse immunitaire adaptative normale.10
Treg = cellules T régulatrices.
Cellule T invariante associée aux muqueuses (MAIT)
Qu’est-ce que c’est? Ces cellules T uniques « de type inné » ont des fonctions dans l’immunité innée et adaptative.8 Elles présentent un phénotype de mémoire effectrice et produisent une large gamme de cytokines/molécules qui induisent des réponses cytotoxiques et pro-inflammatoires.8
Rôle dans la SpA : Dans la SpA, les cellules MAIT peuvent induire de l’IL-17 et de l’IFN-γ et la production de granzyme B dans la synoviale. Les cellules MAIT situées dans la circulation peuvent également induire l’augmentation de la production d’IL-17 et d’IL-22, ce qui potentialise un état pro-inflammatoire.4,8
Cellules tueuses naturelles (NK)
Qu’est-ce que c’est? Des éléments essentiels du système immunitaire inné qui utilisent des granzymes pour détruire les bactéries, virus et cellules cancéreuses sans activation préalable. Les cellules NK peuvent être divisées en 2 groupes principaux (dim/bright) en fonction de la quantité de CD56 exprimée.2
Rôle dans la SpA : La SpA est caractérisée par une augmentation significative du nombre de cellules tueuses CD56dim. L’équilibre des récepteurs de surface cellulaire des cellules NK qui reconnaissent HLA-B27 change.2 Normalement, les récepteurs KIR3DL1 sont plus répandus sur les cellules NK, ce qui conduit à l’inhibition de la fonctionnalité cytolytique des NK. Dans la SpA, il y avait moins de récepteurs KIR3DL1 que chez les témoins sains.2 Les cellules NK peuvent également sécréter des cytokines pro-inflammatoires telles que les TNF-α et les IFN-γ, dont on a montré qu’elles jouaient un rôle dans la SpA.4
Cellules T CD8+
Qu’est-ce que c’est? Les cellules T CD8+ sont un élément important du système immunitaire adaptatif. Elles ont diverses fonctions, telles que la production de cytokines pro-inflammatoires, la production de granules cytotoxiques (comme les cellules NK) et la signalisation Fas/Fas-ligand.2
Rôle dans la SpA : Dans la SpA, les cellules T CD8+ produisent des cytokines pro-inflammatoires telles que le TNF-α, l’IFN-γ, et l’IL-17, ce qui renforce l’état inflammatoire chronique.2 Les cellules T CD8+ lysent également les cellules par le biais de la sécrétion de perforine/granzyme (granule cytotoxique) et de la signalisation Fas/Fas-ligand.2
Cellules T auxiliaires 17 (Th17)
Qu’est-ce que c’est? Un sous-ensemble de cellules T CD4+ caractérisées par leur production de la cytokine pro-inflammatoire IL-17 qui peut elle-même produire d’autres cytokines pro-inflammatoires telles que l’IL-6, l’IL-26 et l’IFN-γ.2
Rôle dans la SpA : Dans la SpA, des niveaux élevés d’IL-23 peuvent induire la production de cellules Th17.2 Un nombre élevé de cellules Th17 peut entraîner une surproduction d’IL-17, ce qui renforce encore l’état pro-inflammatoire, y compris la production d’autres cytokines inflammatoires telles que l’IL-22 et le TNF-α.2,4 Des niveaux élevés d’IL-17 peuvent également induire la production d’autres médiateurs pro-inflammatoires à partir de divers types de cellules telles que les fibroblastes, les cellules endothéliales, les cellules dendritiques et les macrophages.2
Cellules T auxiliaires (Th1)
Qu’est-ce que c’est? Un sous-ensemble de cellules T CD4+ qui jouent un rôle important dans l’identification et la destruction des pathogènes viraux et bactériens.2 Ces cellules sécrètent des cytokines pro-inflammatoires telles que l’interféron gamma (IFN-γ), l’IL-2 et le TNF-α afin d’activer d’autres cellules immunitaires ciblées et d’initier des réponses immunitaires.2
Rôle dans la SpA : Le rôle de ces cellules dans la SpA fait encore l’objet de débats. Certaines études ne montrent aucune différence dans le nombre de cellules Th1 et la production pro-inflammatoire d’IFN-γ, alors que d’autres études montrent une augmentation des cellules T CD4+ productrices d’IFN-γ et une augmentation des niveaux d’IFN-γ et de TNF-α dans le sérum des patients.2
Dysrégulation des cytokines dans l’axSpA
À la suite d’une lésion des enthèses, les cellules locales produisent des chimio-attractants qui agissent comme des médiateurs de l’inflammation. Cela active la sécrétion de cytokines par les cellules immunitaires locales et les lymphocytes innés. Cela active la sécrétion de cytokines par les cellules immunitaires locales et les lymphocytes innés. Dans un état d’équilibre, cela active des mécanismes de régulation et de réparation efficaces. Cependant, dans l’axSpA, ce processus n’est pas équilibré et une dysrégulation des cytokines se produit.1,11-13
La dysrégulation des cytokines se caractérise par un excès de cytokines inflammatoires et/ou un déficit de cytokines régulatrices qui peuvent provoquer une formation anormale de tissus osseux. L’équilibre des cytokines est influencé par des facteurs génétiques, le microbiome, ainsi que par des facteurs environnementaux qui n’ont pas tous été identifiés.11,13

Facteurs de risque génétiques
L’un des principaux facteurs de risque génétiques dans l’axSpA est l’association étroite de la SA avec la présence du facteur héréditaire HLA allèle B27 (HLA-B27).14 L’antigène HLA-B27 peut contribuer à la production de cytokines inflammatoires dans l’axSpA en raison de la réponse aux protéines mal repliées.14
Influence du microbiome
Dans l’axSpA, il existe une association entre le microbiome et le développement de la maladie.15 Une proportion importante de cellules productrices d'IL-17 et de cellules T régulatrices sont issues de l’intestin, et un profil de microbiome différent a été observé chez les patients atteints de SA par rapport aux personnes non atteintes.15
Sites de l’inflammation
Des cytokines différentes ont été associés à différents sites et ont des rôles distincts en fonction des tissus.16
-

Articulation
TNF, IL-17, IL-23p19, IL-12/23p40
-

Squelette axial
IL-17, TNF
-

Enthèse
IL-17, IL-12/23p40, TNF, IL-23p19
-
Épiderme
IL-17, IL-23p19, IL-12/23p40, TNF
-

Intestin
IL-12/23p40, TNF, IL-23p19
© Reproduction de Siebert S, Millar NL, McInnes IB. Why did IL-23p19 inhibition fail in AS: a tale of tissues, trials or translation? [Quelles sont les raisons de l’échec de l’inhibition des Il-23p19 dans la SA : une histoire de tissus, d’essais ou de traduction ?] Ann Rheum Dis. 2019;78(8):1015-1018 avec l’autorisation de BMJ Publishing Group Ltd.

En savoir sur les cytokines clés qui peuvent être dérégulées et entraîner l’inflammation


SALLE SUIVANTE DE L’EXPOSITION SUR LA PATHOBIOLOGIE
Lésions osseuses
Découvrez les processus pathogènes complexe qui peuvent provoquer des lésions osseuses chez les patients atteints d’axSpA.
SALLE PRÉCÉDENTE
Vue d’ensemble et rôle des cytokines
Pour de plus amples informations sur l’axSpA et le PsA, veuillez vous inscrire sur le site UCBCares® Rhumatologie
- Furst DE, Louie JS. Targeting inflammatory pathways in axial spondyloarthritis [Cibler les voies de l'inflammation dans la spondyloarthrite axiale]. Arthritis Res Ther. 2019;21(1):135. Published 2019. doi:10.1186/s13075-019-1885-z
- Rezaiemanesh A, Abdolmaleki M, Abdolmohammadi K, et al. Immune cells involved in the pathogenesis of ankylosing spondylitis [Cellules de l’immunité impliquées dans la pathogénèse de la spondylarthrite ankylosante]. Biomed Pharmacother. 2018;100:198-204. doi:10.1016/j.biopha.2018.01.108
- Rosine N, Miceli-Richard C. Innate cells: the alternative source of IL-17 in axial and peripheral spondyloarthritis? [Cellules innées : l’autre source d’IL-17 dans les spondylarthrites axiales et périphériques ?]. Front Immunol. 2021;11:553742. Published 2021. doi:10.3389/fimmu.2020.553742
- Veale DJ, Fearon U. The pathogenesis of psoriatic arthritis [La pathogénèse du rhumatisme psoriasique]. Lancet. 2018;391(10136):2273-2284. doi:10.1016/S0140-6736(18)30830-4
- Kambayashi T, Laufer TM. Atypical MHC class II-expressing antigen-presenting cells: can anything replace a dendritic cell? [Cellules présentatrices d'antigènes exprimant un CMH de classe II atypique : la cellule dendritique est-elle remplaçable ?] Nat Rev Immunol. 2014;14(11):719-730. doi:10.1038/nri3754
- Fang W, Zhang Y, Chen Z. Innate lymphoid cells in inflammatory arthritis [Les cellules lymphoïdes innées dans le rhumatisme inflammatoire]. Arthritis Res Ther. 2020;22(1):25. doi: 10.1186/s13075-020-2115-4 181
- Bank I. The role of gamma delta T cells in autoimmune rheumatic diseases [Le rôle des cellules T gamma delta dans les maladies rhumatismales auto-immunes]. Cells. 2020;9(2):462. Published 2020. doi:10.3390/cells9020462
- Toubal A, Nel I, Lotersztajn S, Lehuen A. Mucosal-associated invariant T cells and disease [Les cellules T invariantes associées aux muqueuses et la maladie]. Nat Rev Immunol. 2019;19(10):643-657. doi:10.1038/s41577-019-0191-y
- Shevyrev D, Tereshchenko V. Treg Heterogeneity, Function, and Homeostasis [Hétérogénéité, fonction et homéostasie des Treg]. Front Immunol. 2020;10:3100. Published 2020. doi:10.3389/fimmu.2019.03100
- Lai NL, Zhang SX, Wang J, et al. The proportion of regulatory T cells in patients with ankylosing spondylitis: A Meta-Analysis [La proportion de cellules T régulatrices chez les patients atteints de spondylarthrite ankylosante : une méta-analyse]. J Immunol Res. 2019;2019:1058738. Published 2019. doi:10.1155/2019/1058738
- Watad A, Bridgewood C, Russell T, et al. The early phases of ankylosing spondylitis: emerging insights from clinical and basic science [Les phases initiales de la spondyloarthrite ankylosante : perspectives émergentes de la recherche clinique et fondamentale]. Front Immunol. 2018;9:2668. doi: 10.3389/fimmu.2018.02668
- McGonagle DG, McInnes IB, Kirkham BW, et al. The role of IL-17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies [Le rôle de l’IL-17A dans la spondylarthrite axiale et le rhumatisme psoriasique : avancées et controverses récentes]. Ann Rheum Dis. 2019;78:1167–1178
- Watad A, Rowe H, Russell T, et al. Normal human enthesis harbours conventional CD4+ and CD8+ T cells with regulatory features and inducible IL-17A and TNF expression [L’enthèse normale humaine contient des cellules T CD4+ et CD8+ classiques avec des caractéristiques régulatrices et une expression d’IL-17A et de TNF inductible]. Ann Rheum Dis. 2020;79(8):1044-1054. doi:10.1136/annrheumdis-2020-217309
- Simone D, Al Mossawi MH, Bowness P. Progress in our understanding of the pathogenesis of ankylosing spondylitis [Progrès dans notre compréhension de la pathogénèse de la spondylarthrite ankylosante]. Rheumatology (Oxford). 2018;57(suppl_6):vi4-vi9. doi:10.1093/rheumatology/key001
- Clemente JC, Manasson J, Scher JU. The role of the gut microbiome in systemic inflammatory disease [Le rôle du microbiome intestinal dans les maladies inflammatoires systémiques]. BMJ. 2018;360:j5145. doi:10.1136/bmj.j5145
- Siebert S, Millar NL, McInnes IB. Why did IL-23p19 inhibition fail in AS: a tale of tissues, trials or translation? [Quelles sont les raisons de l’échec de l’inhibition des Il-23p19 dans la SA : une histoire de tissus, d’essais ou de traduction ?] Ann Rheum Dis. 2019;78(8):1015-1018. doi:10.1136/annrheumdis-2018-213654